Artículos científicos
Contenido de carbono en un ecosistema semiárido del centro de México
Carbon content in a semi-arid ecosystem in central Mexico
1Rocio Becerril-Piña, 2Enrique González-Sosa, *1Carlos Alberto Mastachi-Loza, 1Carlos Díaz-Delgado, 3Norma Maricela Ramos-Salinas
1 Centro Interamericano de Recursos del Agua (CIRA), Facultad de Ingeniería, UAEMex. Carretera Toluca-Atlacomulco, km 14.5. 50110, Toluca, Estado de México. * mastachii@hotmail.com
2 Laboratorio de Hidráulica, Facultad de Ingeniería. UAQ.
3 Facultad de Contaduría y Administración. UAQ. Querétaro, Qro.
Artículo recibido: 13 de junio de 2012
Aceptado: 21 de enero de 2014
RESUMEN
En las últimas décadas se han propuesto diversas ecuaciones alométricas (EA) para especies tropicales y subtropicales a fin de estimar el contenido de carbono (CC) en la biomasa aérea, sin embargo, los ecosistemas semiáridos han sido poco estudiados a pesar de constituir cerca del 40 % de la superficie de México. El objetivo de este estudio fue desarrollar EA para determinar el CC en la biomasa aérea en mezquite (Prosopis laevigata), huizache (Acacia farnesiana) y herbáceas representativas de una región semiárida del centro del país. Se seleccionaron y muestrearon por método destructivo cinco individuos de cada especie para estimar biomasa seca total y por componente (hojas, ramas y fuste), los cuales se correlacionaron con parámetros de fácil medición en campo: cobertura de la copa, radio de la copa, altura total y volumen, encontrándose valores de R2 entre 0.96 y 0.80 dependiendo de la especie. Mediante información satelital se estimó la distribución espacial del CC en la Cuenca Dolores Hidalgo (Guanajuato), localizada en la región semiárida del centro de México. La cobertura vegetal del área de estudio se reclasificó en tres tipos: abierta, semiabierta y cerrada. El contenido de carbono en la cobertura abierta fue de 2.4 Mg C ha-1, semiabierta 10.26 Mg C ha-1 y cerrada de 21.20 Mg C ha-1. Los resultados sugieren que los ecosistemas semiáridos de la zona central de México representan un potencial considerable como sumideros de carbono con un promedio de 11 Mg C ha-1.
Palabras clave: Biomasa aérea, semiárido, ecuaciones alométricas, contenido de carbono.
ABSTRACT
During the last decades, several allometric equations (AE) have been proposed for tropical and subtropical species in order to estimate the carbon content (CC) in the aboveground biomass. However, semi-arid environments have been scarcely studied despite the fact that they represent almost 40 % of Mexicos surface. The purpose of this study was to develop AE to determine the CC in the aboveground biomass of the mezquite (Prosopis laevigata), huizache (Acacia farnesiana) and herbaceous plants that represent a semi-arid region in central Mexico. Five individuals of each species were selected and sampled using a destructive method in order to estimate the total dry biomass and the biomass per component (leaves, branches and trunk). These were correlated with parameters that were easy to record in the eld: canopy cover, canopy radius, total height and volume. Values of R2 varied from 0.96 to 0.80, depending on the species. The spatial distribution of the CC in the Dolores Hidalgo (Guanajuato) basin, which is located in the semi-arid region of central Mexico, was estimated using satellite information. The vegetation cover in the study area was re-classied as open, semi-open and closed. Carbon content was 2.4 Mg C ha-1 in the open cover, 10.26 Mg C ha-1 in the semi-open cover and 21.20 Mg C ha-1 in the closed cover areas. The results suggest that the semi-arid ecosystems in central Mexico present an important potential as carbon sinks, with an average of 11 Mg C-1.
Key words: Aboveground biomass, semi-arid, allometric equations, carbon content.
INTRODUCCIÓN
La degradación de los recursos naturales producto de la actividad antropogénica, ha alterado los ecosistemas con repercusiones socioeconómicas importantes, principalmente por el incremento de los gases con efecto invernadero (GEI). Siendo el dióxido de carbono (CO2) uno los principales GEI que contribuye al calentamiento global (Solomon et al. 2007). Al respecto, durante el 2008 el promedio atmosférico de CO2 alcanzó niveles de 385.3 ppm, lo que representa un incremento del 38 % con respecto a la era preindustrial (Organización Meteorológica Mundial 2009). Ante tal escenario, se han implementado estrategias para reducir la emisión de CO2 a la atmósfera mediante procesos bióticos, como lo es la capacidad de la vegetación de fijar carbono mediante el proceso de fotosíntesis y en el caso de especies leñosas, almacenarlo en forma de biomasa vegetal por periodos prolongados (Acosta-Mi relés et al. 2002).
La capacidad de fijar carbono por los ecosistemas ha sido investigada con gran interés como una medida de mitigación (Schulze et al. 2000) subrayando que dicha capacidad de fijar y almacenar carbono está en función de la composición, densidad y edad vegetal, impulsando con ello la importancia de los estudios locales y regionales (Conti et al. 2003, Chave et al. 2003, Návar 2010). Además, la cuantificación precisa del carbono almacenado en la vegetación es importante para determinar la magnitud de las reservas de biomasa; el almacén ante el cambio de uso de suelo, y con ello, mejorar el conocimiento de cómo los ecosistemas podrían responder al cambio climático (Litton y Kauffman 2008).
Diversos métodos se han desarrollado para determinar la biomasa aérea y el contenido de carbono en la vegetación, a partir de muestreos destructivos o bien mediante la aplicación de ecuaciones alométricas (Ketterings et al. 2001) así como la aplicación de teledetección (Lu 2005) para generar estimaciones de biomasa aérea en diversos ecosistemas.
La concentración de carbono en el componente leñoso de las plantas es aproximadamente 50 % de biomasa seca, sin embargo, puede variar este valor dependiendo de la forma de crecimiento dominante. De acuerdo con Tolunay (2009) los valores de biomasa pueden fácilmente ser convertidos en unidades de carbono donde el factor de conversión es 0.5 de la biomasa aérea. El procedimiento más común es el método de estimación por medio de análisis de regresión. La implementación de esta herramienta estadística requiere el muestreo destructivo de algunos organismos para relacionar alguna variable alométrica con la biomasa (Díaz-Franco et al. 2007). Durante las últimas décadas se han propuesto diversas ecuaciones alométricas para estimar biomasa en selvas, bosques y plantaciones comerciales (Chave et al. 2003, Soto-Pinto 2010). Sin embargo, los modelos para ecosistemas semiáridos son limitados y poco estudiados (Návar et al. 2004). Varios autores (Grünzweig et al. 2003, Lal 2003, Nosetto et al. 2006) consideran las regiones áridas y semiáridas como sumideros potenciales de carbono, ya que ocupan más del 45 % de la superficie del planeta. Por ejemplo Geesing et al. (2000) mencionaron la importancia del mezquite (Prosopis spp.) y huizache (Acacia spp.) en los procesos de nitrógeno y carbono en el suelo, haciendo hincapié en el potencial de las leguminosas arbóreas para impactar positivamente en la captura de carbono mundial.
En México, las zonas semiáridas representan cerca del 40 % de acuerdo con los resultados del Inventario Forestal Nacional (CONAFOR 2009) con una cobertura vegetal dominada por matorrales con diferentes variantes. Una característica común de estos ecosistemas es la distribución irregular de la cobertura en parches de vegetación, dominados por especies leñosas y numerosas especies de plantas herbáceas perennes y anuales, así como suelo desnudo. De estas características se dificulta la delimitación de las asociaciones vegetales y su descripción (Cervantes 2002). En general, se puede observar que los matorrales del centro del país presentan un estrato alto con mezquites y huizaches, en ocasiones es posible reconocer un estrato medio, siendo Opuntia el elemento más frecuente. El estrato inferior que fluctúa con una cobertura acorde a la época del año y cobertura del estrato superior (Briones y Villareal 2001).
Los objetivos de la presente investigación fueron: 1) desarrollar ecuaciones alométricas (EA) para especies dominantes en la región semiárida del centro de México y 2) estimar el Contenido de Carbono (CC) en la biomasa aérea en una cuenca mediante técnicas de teledetección.
MATERIALES Y MÉTODOS
Descripción del sitio de estudio
La investigación se llevó a cabo en la cuenca de Dolores Hidalgo, en la región semiárida de Guanajuato, México. Los organismos vegetales para generar la base de datos fueron obtenidos del predio El Cortijo localizado a 20 km al Este del municipio de Dolores Hidalgo entre los 21° 09' Norte y 100° 56' Oeste. De acuerdo con varios investigadores (Frías-Hernández et al. 1999, Reyes-Reyes et al. 2003, Mastachi-Loza et al. 2010) es una zona accesible para la realización de diversos estudios relacionados con procesos de superficie. La cuenca presenta una superficie de 996.42 km2, con una elevación media de 2 069 msnm. La vegetación dominante es el matorral xerófilo, con algunas zonas de bosque de coníferas y grandes extensiones de suelo de uso agrícola. La presencia de sitios degradados muestra el efecto que ha tenido el cambio de uso de suelo y el uso de recursos sin manejo, observándose que en su mayoría se trata de una zona degradada con problemas de erosión hídrica.
Construcción de ecuaciones alométricas (EA)
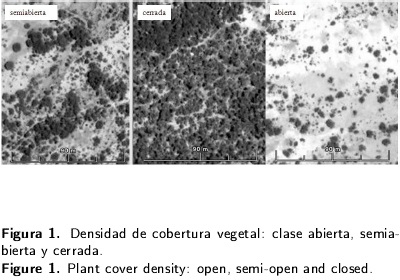
En una primera etapa se realizaron recorridos en campo para caracterizar la zona y ubicar sitios de muestreos. Como resultado se identificaron visualmente tres sitios con diferente densidad de cobertura vegetal: tipo abierta, tipo semiabierta y tipo cerrada (Figura 1). Para cada tipo de cobertura se implementaron dos transectos de 100 m2 (2 x 50 m), se tomaron medidas de altura, radio de la copa y perímetro basal de todos los individuos de más de 0.5 m de altura. Se calculó frecuencia, dominancia y densidad para luego construir el índice de Valor de Importancia (IVI), utilizado por ser un buen descriptor de la importancia de especies en un área (Curtis y Mclntosh 1951).
Generalmente los muestreos destructivos son difíciles y caros, especialmente en este tipo de ecosistema dada su condición de fragilidad y el alto costo que implica la destrucción de componentes tan importantes en la formación de islas de fertilidad (Geesing et al. 2000), considerando que son los únicos de tipo forestal y por tanto, los de mayor protección al suelo durante todo el año. Ante tal situación, se cortaron cinco individuos de Prosopis laevigata, Acacia farnesiana y 10 de las otras especies incluyendo pastos. Con base en los resultados de IVI y las tallas de los organismos se eligieron individuos representativos para su destrucción, registrándose su altura y diámetros de la copa. Para el caso de especies leñosas se cortaron, separaron y pesaron los compartimentos: hojas, ramas y fuste. Las muestras se secaron al aire libre hasta obtener peso constante (peso seco). Las características alométricas y el peso seco, fueron la base para construir las EA, por lo que se eligió un modelo sencillo de la forma
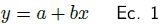
donde Y es la biomasa aérea total (kg), x es alguna característica alométrica, a y b parámetros del modelo.
Para validar los modelos propuestos para Prosopis laevigata y Acacia farnesiana se comparó con las ecuaciones reportadas por Návar et al. (2004). La bondad de los modelos se valoró estadísticamente mediante el sesgo (B); el cual evalúa la desviación del modelo con respecto a los valores observados (Ec. 2), la eficiencia (E); que determina la capacidad de un modelo de predecir valores observados (Ec. 3) y la raíz del error cuadrático medio (RECM) (Ec. 4) que analiza la desviación de las estimaciones respecto a los valores de referencia.
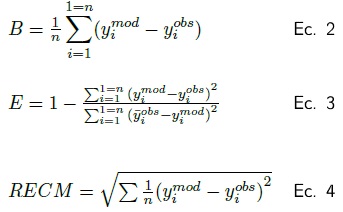
Estimación de contenido de carbono
Se clasificó el uso de suelo y vegetación de la cuenca con imágenes de satélite Landsat TM del año 2005 (fecha en la que se realizaron los muestreos), formando un mosaico con las imágenes p27r45, p27r46 y p28r45. Mediante el uso del software Idrisi-Taiga 16.0, se realizó una clasificación supervisada a partir de los seis sitios donde se llevaron a cabo los muestreos, a los que se denominó sitios de entrenamiento. Se digitalizaron los polígonos a fin de extraer las firmas espectrales y se aplicó un clasificador de máxima probabilidad (maxlike). Este clasificador evalúa la probabilidad de que un pixel dado pertenezca a una categoría y clasifica el pixel a la categoría con la mayor probabilidad de pertenecer. Por último, se asignó un valor promedio de CC para cada clase de cobertura, multiplicándose por su área, a fin de determinar el contenido de carbono en la biomasa área del matorral en la cuenca.
RESULTADOS
Composición y estructura de la vegetación
La composición florística se constituyó por 1 176 individuos en 600 m2, identificándose 13 especies; las familias mayormente representadas fueron: Asteraceae, Cactaceae, Mimosaceae y Poaceae. La estructura de la comunidad en su totalidad se conformó por el 87 % de herbáceas, 9 % arbustos y sólo un 4 % arboles. La estructura horizontal fue dominada por pastos; la presencia de organismos de gran talla se debió a Prosopis laevigata (mezquite), Acacia farnesiana (huizache), Opuntia imbricata (cardenche) y Opuntia spp. (nopaleras). Los análisis de vegetación permitieron caracterizar la estructura horizontal y vertical de las tres clases de cobertura. La clase de tipo abierta presentó una cobertura menor al 30 % con grandes parches de suelo desnudo, la semiabierta exhibió áreas cubiertas en su mayoría por arbustos y pastos en un 60 %; en tanto que la cerrada está cubierta por árboles, arbustos y herbáceas en un 90 % (Tabla 1). En el caso del tipo abierta se obtuvo una densidad de 1 050 individuos de mezquite y huizache por hectárea, así como 1 350 individuos para la semiabierta y 2 250 en la cerrada.
Construcción de ecuaciones alométricas
Los análisis de IVI permitieron identificar las especies utilizadas para los muestreos destructivos: Prosopis laevigata, Acacia farnesiana, Asterohypti ssp., Verbesina virgata, Bahía absinthifolia y pastos. La distribución de biomasa por componentes en Prosopis laevigata el fuste representó 68 %, las ramas 27 %; contrario al caso de Acacia farnesiana donde las ramas representaron la mayor porción de biomasa con un 80 % y el fuste sólo 17 %. En ambos casos el componente hojas representó la menor porción. Las ecuaciones alométricas para mezquite, huizache, herbáceas y toda la comunidad presentaron coeficientes de correlación mayores a 0.80 (Tabla 2 y Figura 2). Los modelos obtenidos son en general lineales, excepto para Acacia farnesiana que se consideró un modelo de tipo exponencial (Y = exp [a+bx]). Siendo el volumen el parámetro necesario para determinar biomasa seca, sin embargo, este debe ser considerado con reserva ya que considera a los organismos como formas geométricas (cono invertido) con un espacio lleno en su totalidad, lo cual no es real. Para el caso de la comunidad se consideraron los 60 organismos muestreados. La ecuación alométrica indica que existe una relación estadísticamente significativa entre biomasa seca y cobertura, aunque cabe destacar que el modelo sólo explica el 64 % de la variabilidad de la biomasa seca (Tabla 2 y Figura 2).
Para la validación de los modelos de Prosopis laevigata y Acacia farnesiana se compararon con las ecuaciones reportadas por Návar et al. (2004), las cuales fueron desarrolladas para el matorral Tamaulipeco localizado en la zona noroeste del país. Los valores de eficiencia resultaron óptimos en ambos modelos para Prosopis laevigata, no para el caso de Acacia farnesiana donde el modelo exponencial propuesto en este estudio resultó tener la mejor eficiencia (Tabla 3). Sin embargo, cabe destacar que los modelos con los que se compara este estudio, fueron desarrollados para una fisonomía, composición y estructura de vegetación con grandes diferencias con respecto al matorral xerófilo del centro del país, de aquí la importancia de los estudios locales (Návar 2010).
Estimación de Contenido de carbono
A partir de la clasificación supervisada en la cuenca de Dolores Hidalgo se determinaron los siguientes usos de suelo: agrícola, cuerpos de agua, bosque y matorral xerófilo. El matorral se re-clasificó y determinaron las superficies semiabierta, cerrada y abierta con 24 000 ha, 14 000 ha y 9 000, ha respectivamente (Figura 3). Los resultados mostraron que la biomasa aérea se incrementa al aumentar la densidad de la vegetación en el orden: cobertura abierta 4.87 Mg-1, semiabierta 20.53 Mg ha-1 y cerrada 42.40 Mg ha-1. Estos resultados concuerdan con lo mencionado por Yerena-Yamallel et al. (2011) quienes encontraron que la producción de biomasa se incrementa con el gradiente geomórfologico, donde se destaca particularmente la disponibilidad hídrica, entre otros aspectos. Así mismo los reservorios de carbono (biomasa aérea*0.50) se estimaron con valores de 2.4 Mg C ha-1, 12.6 Mg C ha-1 y 21.20 Mg C ha-1 respectivamente, con un promedio de 11 Mg C ha-1. Considerando este último dato de biomasa seca y el área de cada clase de cobertura se determinó que la zona de matorral en el área de estudio contiene un total de 500 Gg C en biomasa aérea.
DISCUSIÓN
Los valores estimados de biomasa aérea en la superficie cerrada y semiabierta (42.40 y 20.53 Mg ha-1 respectivamente) se encuentra entre los rangos reportados por Návar (2008) para el matorral espinoso tamaulipeco (12.93 - 78.44 Mg ha-1). Adicionalmente, el valor de la superficie abierta (4.87 Mg ha-1) es semejante al reportado por Yerena-Yamallel et al. (2011) para matorral primario de clases diamétricas pequeñas y densidades menores a 100 ind ha-1. Por su parte, Burquéz y Martínez- Yrízar (2011) reportan valores entre 6.7 y 23.78 Mg ha-1 para comunidades del desierto de Sonora. Los valores reportados de contenido de carbono en la biomasa aérea para el centro del país se ubican en el rango de 220 Mg C ha-1 dependiendo del tipo de cobertura. Para poner en contexto los valores aquí obtenidos, Masera et al. (2001) reportan para bosques semiáridos en México un contenido de 19 Mg C ha-1 y Návar et al. (2002) valores entre 15 y 25 Mg C ha-1 para el noroeste de México, esto concuerda con los valores estimados por este estudio. Yerena-Yamallel et al. (2011) reportan valores inferiores (11.70 Mg C ha-1) para matorral primario. Sin embargo, es importante señalar que este estudio requirió de la destrucción de menos individuos para llegar a estos resultados. Esto es importante, ya que especies como Acacia farneciana y Prosopis laevigata son de crecimiento lento (Pometti et al. 2009), además de ser elementos importantes en la regulación de procesos en los ecosistemas semiáridos (Challenger 1995). Por lo que el costo de hacer muestreos destructivos extensivos con el fin de obtener una muestra representativa de la comunidad, tiene un costo ambiental elevado. No obstante, se corrobora la importancia de los estudios locales basados en la construcción y aplicación de ecuaciones alométricas para estimar CC en zonas semiáridas, considerando la gran heterogeneidad y fragilidad que estas comunidades presentan.
El área de estudio muestra que los sitios de cobertura abierta presentaron el menor reservorio con 2.4 Mg C ha-1, siendo estas áreas las de mayor degradación; en tanto que los sitios de cobertura cerrada alcanzaron el reservorio más alto con 21.20 Mg C ha-1. No obstante, estas áreas son las menos representativas, lo que hace referencia al constante cambio de uso de suelo que se presenta en estos ecosistemas (SEMARNAT 2012). Por lo tanto, dada la extensión territorial de la vegetación de las zonas semiáridas en México y los datos reportados en este estudio para cobertura cerrada sugieren gran potencial como sumideros de carbono ante el incremento de GEI. Una estrategia para incrementar estos sumideros sería mediante la implementación de planes de manejo y restauración específicamente con mezquite y huizache ya que en estos organismos se concentra la mayor biomasa aérea. En este sentido, es deseable destacar la importancia de los mezquites y huizaches de tipo forestal ya que en ellos se encuentra el mayor reservorio de carbono, además de ser especies vitales en la formación de islas de fertilidad y retención de suelo en estos ecosistemas semiáridos.
AGRADECIMIENTOS
Al CONACYT por la beca de posgrado otorgada a Roció Becerril Piña, a los Sres. Jaime Ocampo y Virginia Velázquez por su apoyo en los muestreos destructivos.
LITERATURA CITADA
Acosta-Mirelés M, Vargas-Hernández J, Velázquez-Martínez A, Etchevers-Barra J (2002) Estimación de la biomasa aérea mediante el uso de relaciones alométricas en seis especies arbóreas en Oaxaca, México. Agrociencia 36: 725-736.
Briones O, Villareal QJ (2001) Vegetación y flora de un ecotono entre las provincias del altiplano y de la planicie costera del noreste de México. Acta Botánica Mexicana 55: 39-67.
Búrquez A, Martínez-Yrízar A (2011) Accuracy and bias on the estimation of aboveground biomass ¡n the woody vegetation of the Sonoran Desert. Botany 89:625-633.
Cervantes RM (2002) Plantas de importancia económica en las zonas áridas y semiáridas de México. UNAM. Instituto de Geografía, México. 155 p.
Challenger A (1995) Utilización y conservación de los ecosistemas terrestres de México: pasado, presente y futuro. CONABIO, Instituto de Ecología-UNAM y Agrupación Sierra Madre SC, México. 847 p.
Chave J, Condit R, Lao S, Caspersen J, Foster R, Hubbell S (2003) Spatial and temporal variations of biomass in a tropical forest: results from a large census plot in Panama. Journal of Ecology 91: 240-252.
CONAFOR (2009) El inventario nacional forestal y de suelos de México 2004-2009. Una herramienta que da certeza a la planeación, evaluación y el desarrollo forestal de México. Jalisco México, www.conafor.gob.mx/biblioteca/Inventario-Nacional-Forestal-y-de-Suelos.pdf. Fecha de consulta 3 agosto 2012.
CONABIO (1998) Climas (Clasificación Köppen, modificado por García). Escala 1:1 000 000. México. http://www.conabio.gob.mx/informacion/gis/. Fecha de consulta 10 de mayo 2012.
Conti G, Enrico L, Casanoves F, Díaz S (2003) Shrub biomass estimation in the semiarid Chaco forest: a contribution to the quantification of an underrated carbon stock. Annals of Forest Science 70: 515-524.
Curtis JT, McIntosh PR (1951) An upland forest continuum in the Prairie-Forest border region of Wisconsin. Ecology 32: 476-496.
Díaz-Franco R, Acosta-Mireles M, Carrillo-Anzures F, Buendía-Rodríguez E, Flores-Ayala E, Etchevers-Barra J (2007) Determinación de ecuaciones alométricas para estimar biomasa y carbono en Pinus patula Schl. et Cham. Madera y Bosques 13: 25-34.
Frías-Hernández JT, Aguilar-Ledezma AL, Olalde-Portugal V, Balderas-López JA, Alvarado-Gil JJ, Castro JJ, et al. (1999) Research note soil characteristics in semiarid highlands of central Mexico as affected by mesquite trees (Prosopis laevigata). Arid Land Research and Rehabilitation 13(1): 305-312.
Geesing D, Felker P, Bingham R (2000) Influence of mesquite (Prosopis glandulosa) on soil nitrogen and carbon development: implications for global carbon sequestration. Journal of Arid Environment 46(2): 157-180.
Grünzweig JM, Lin T, Rotenberg E, Schwartz A, Yakir D (2003) Carbon sequestration in arid-land forest. Global Change Biology 9(5): 791-799.
Ketterings Q, Coe R, Van Noordwijk M, Ambagau Y, Palm C (2001) Reducing uncertainty in the use of allometric biomass equations for predicting aboveground tree biomass in mixed secondary forests. Forest Ecology and Management 146: 199-209.
Lal R (2003) Carbon sequestration in drylands ecosystems. Environmental management 33(4): 528-544.
Litton CM, Kauffman JB (2008) Allometric models for predicting aboveground biomass in two widespread woody plants in Hawaii. Biotropica 40(3): 313-320.
Lu D (2005) Aboveground biomass estimation using Landsat TM data in the Brazilian Amazon. International Journal of Remote Sensing 26: 2509-2525.
Masera OR, Cerón A, Ordóñez A (2001) Forestry mitigation options for Mexico: finding synergies between national sustainable development priorities and global concerns. Mitigation and Adaptation Strategies for Global Change 6: 291-312.
Mastachi-Loza CA, González-Sosa E, Becerril-Piña R, Braud I (2010) Pérdidas por intercepción en mezquite (Prosopis laevigata) y huizache (Acacia farnesiana) de la región semiárida del centro de México. Tecnología y Ciencias del Agua 1: 103-120.
Návar CJ (2008) Carbon fluxes resulting from land-use changes in the Tamaulipan thornscrub of northeastern Mexico. Carbon Balance and Management 3 (1): 1-11.
Návar CJ (2010) Biomass allometry for tree species of Northwestern Mexico. Tropical and Subtropical Agroecosystems 12: 507-519.
Návar J, Méndez E, Dale V (2002) Estimating stand biomass in the Tamaulipan thornscrub of northeastern Mexico. Annals of Forest Science 59: 813-821.
Návar J, Méndez E, Nájera A, Graciano J, Dale V, Parresol B (2004) Biomass equations for shrub species of Tamaulipan thornscrub of North-easter Mexico. Journal of Arid Environments 59: 657-674.
Nosetto MD, Jobbágy EG, Paruelo JM (2006) Carbon sequestration in semi-arid rangelands: Comparison of Pinus ponderosa plantations and grazing exclusion in NW Patagonia. Journal of Arid Environments 67(1): 142-156.
OMM (2009) Organización Meteorológica Mundial. Greenhouse gas bulletin No. 5. The state of greenhouse gases in the atmosphere using global observations through 2008. Switzerland, www.wmo.int/pages/prog/arep/gaw/ghg/documents/ghg-bulletin2008_en.pdf. Fecha de consulta 20 de septiembre de 2012.
Pometti C, Pizzo B, Brunetti M, Macchioni N, Ewens M, Saidman BO (2009) Argentinean native wood species: Physical and mechanical characterization of some Prosopis species and Acacia aroma (Leguminosae; Mimosoideae). Bioresource Technology 100: 1999-2004.
Reyes-Reyes BG, Zamora-Villafranco E, Reyes-Reyes ML, Frias-Hernández JT, Olalde-Portugal V, Dendooven L (2003) Decomposition of leaves of huizache (Acacia tortuoso) and mesquite (Prosopis spp) in soil of the central highlands of Mexico. Plant and Soil 256(2): 259-370.
Rzedowski J (2006) Vegetación de México. Primera edición digital. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México, 405 p.
SEMARNAT (2012) Informe de la situación del medio ambiente en México. Compendio de estadísticas ambientales indicadores clave y de desempeño ambiental. Edición 2012. México. 361 p.
Schulze DE, Wirth C, Heimann M (2000) Climate change: managing forest after Kyoto. Science 289: 2058-2059.
Solomon S, Quin D, Manning M, Chen Z, Marquis M, Averyt K, et al. (2007) Climate Change 2007: The physical science basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, NY. USA 996 p.
Soto-Pinto L, Anzueto M, Mendoza J, Jimenez GF, de Jong B (2010) Carbon sequestration through agro-forestry in indigenous communities of Chiapas, Mexico. Agroforestry Systems 78: 39-51.
Tolunay D (2009) Carbon concentrations of tree components, forest floor and understorey in young Pinus sylvestris stands in north-western Turkey. Scandinavian Journal of Forest Research 24: 394-402.
Yerena-Yamallel Jl, Jiménez-Pérez J, Alanís-Rodríguez E, Aguirre-Calderon OA, Treviño-Garza J (2011) Contenido de carbono en la biomasa aérea en diferentes sistemas de uso de suelo, en el matorral espinoso tamaulipeco. Revista Latinoamericana de Recursos Naturales. 7(2): 71-77.