Artículos científicos
Efecto de Sacharomyces cerevisiae y Kluyveromices marxianus durante el tiempo de fermentación en la calidad nutritiva del nopal forrajero
Effect of Sacharomyces cerevisiae and Kluyveromices marxianus on the nutritional quality of the forage prickly pear during the time of fermentation
*Esperanza Herrera-Torres, Manuel Murillo, Leslie Berumen, Jesús Páez, Guadalupe Villarreal
Facultad de Medicina Veterinaria y Zootecnia, División de Estudios de Posgrado, UJED. 11.5 km Carretera Durango-Mezquital, Durango, Dgo., México. * hetoes99@yahoo.com.mx
Artículo recibido: 28 de junio de 2013
Aceptado: 22 de enero de 2014
RESUMEN
Recientemente, el nopal forrajero se ha introducido en la alimentación animal. Sin embargo, una limitante del nopal es su bajo contenido de proteína cruda. Una tecnología que se puede utilizar para incrementar la calidad nutritiva del nopal es la fermentación en estado sólido (FES). Por lo tanto, el objetivo de este trabajo fue evaluar el efecto de Kluyveromyces marxianus y Saccharomyces cerevisiae en la dinámica de fermentación del nopal forrajero. Se colocaron 250 g de nopal picado con el 1 % de levadura en matraces de 500 ml, los cuales se incubaron por 24, 48, 72 y 96 h a 32 °C y 28 °C para K. marxianus y S. cerevisiae, respectivamente. A las muestras secas del nopal fermentado se les determinaron los contenidos de materia seca (MS), proteína cruda (PC), fibra detergente neutro (FDN), fibra detergente ácido (FDA), lignina (L) y digestibilidad verdadera in vitro de la MS (DVIVMS). Los datos obtenidos fueron analizados con un diseño completamente al azar con arreglo factorial 2x5 con mediciones repetidas. Se observaron interacciones entre tipo de levadura x tiempo de fermentación para los contenidos de MS, PC, DVIVMS, FDN, FDA y L (P < 0.05). De acuerdo con los resultados obtenidos, las mejores características nutritivas en el nopal fermentado se obtuvieron a las 48 y 96 h de fermentación con S. cerevisiae y K. marxianus respectivamente.
Palabras clave: Nopal, fermentación en estado sólido, levaduras, calidad nutritiva.
ABSTRACT
Forage prickly pear has recently been introduced into animal feed. However, its content of crude protein is low. A biotechnology than may be used to increase the nutritional quality of the prickly pear is solid state fermentation. Thus, the purpose of this study was to evaluate the effect of Kluyveromyces marxianus and Saccharomyces cerevisiae on the fermentation dynamics of the prickly pear. Prickly pear was chopped up and 250 g were placed in 500 ml flasks with 1 % of yeast. It was incubated for 24, 48, 72 and 96 h at 32 and 28 °C for K. marxianus and S. cerevisiae respectively. Dry samples of fermented prickly pear were analysed for dry matter (DM), crude protein (CP), neutral detergent fiber (NDF), acid detergent fiber (ADF), lignin (L) and in vitro true digestibility of the DM (IVTDDM). The data obtained were analysed with a completely random design and a 2 x 5 factorial arrangement with repeated measurements. Interactions were observed between the type of yeast x fermentation time for DM, CP, IVTDDM, NDF, ADF and L (P < 0.05). According to the results obtained, the best nutritional characteristics in the fermented prickly pear were obtained at 48 h and 96 h with 5. cerevisiae and K. marxianus, respectively.
Key words: Prickly pear, solid state fermentation, yeast, nutritional quality.
INTRODUCCIÓN
La producción de forraje en el norte de México es limitada por lo irregular de la distribución de las lluvias durante el año, lo cual resulta en una baja disponibilidad de forraje sobretodo en la época de secas (Murillo et al. 2012). Esto obliga a la suplementación alimenticia durante la época de escasez de forraje con concentrados comerciales para cubrir las necesidades principalmente de proteína y energía de los animales. Sin embargo, el uso de concentrados eleva hasta 40 % el costo de la alimentación, lo que hace necesario emplear nuevas alternativas que abaraten los costos (Herrera, 2011). Bajo estas condiciones de producción, una alternativa que recientemente se viene utilizando es el uso de nopal forrajero en la alimentación del ganado (Gutiérrez et al. 2009). Sin embargo, una limitante del nopal forrajero es su bajo contenido de proteína cruda (4 %, González y Díaz 2009). Una tecnología que se puede utilizar para incrementar la calidad nutritiva del nopal, es la fermentación en estado sólido (FES) por medio de la cual se puede obtener biomasa a partir del empleo de los carbohidratos presentes en el sustrato (Peláez et al. 2011). Este tipo de fermentación permite al mismo tiempo, hidrolizar la celulosa y el empleo de la glucosa (Chávez et al. 2009). Entre los microorganismos más utilizados en este proceso son levaduras como Saccharomyces cerevisiae y algunas especies de Kluyveromyces (Van Markis et al. 2006). Este tipo de levaduras se han empleado para la generación de biomasa microbiana formada principalmente por levaduras, hongos y bacterias. Además, posee un alto valor proteico, por lo que recibe el nombre de proteína unicelular (Grba et al. 2002). El proceso de producción de proteína unicelular es una vía biotecnología adecuada para incrementar el valor proteico de alimentos con bajo contenido de proteína como el nopal (Palmerín et al. 2011). El fermentado de nopal con este proceso le proporciona valor agregado, al obtenerse proteína de calidad para la alimentación animal (Buitrago et al. 2008). El objetivo de este trabajo fue evaluar el efecto de Kluyveromyces marxianus y Saccharomyces cerevisiae en la calidad nutritiva del nopal forrajero a través del tiempo de fermentación.
MATERIALES Y MÉTODOS
Área de estudio
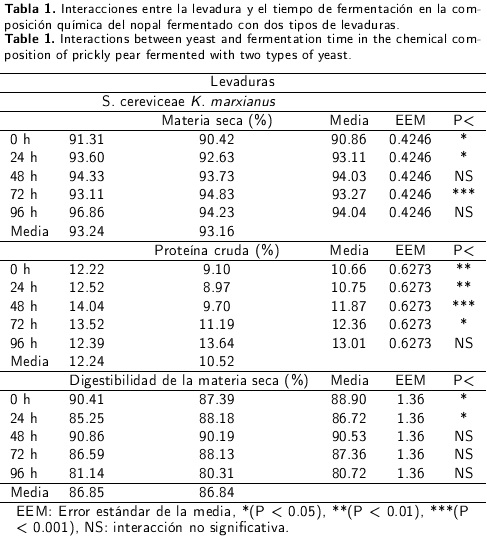
El presente estudio se llevó a cabo en los laboratorios de posgrado del Instituto Tecnológico y de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Juárez, ambas instituciones del Estado de Durango. Las muestras de nopal forrajero (variedad AV6) se obtuvieron en una nopalera perteneciente al rancho Santa Cruz del Aguaje ubicado en el km 17.5 de la Carretera Durango Mezquital a 24° 28 N, 104° 40 W, y 1890 msnm con temperatura media anual de 17.5 °C y precipitación media de 550 mm (INEGI, 2012). La composición química promedio n = 5) de las muestras de nopal evaluadas en el presente estudio se muestra en la Tabla 1.
Activación de la levadura K. marxianus
Se inoculó K. marxianus en caldo de GPY (dextrosa y peptona 2 %, extracto de levadura 1 %) a un pH de 4.8 a 28 °C por 12 h y 120 rpm en un incubadora con agitación (Frazier y Westhoff 1993) para el crecimiento favorable de la levadura. Enseguida se leyó el número de levaduras por mililitro en el caldo mediante la cámara de newbawer. Finalmente se calculó la cantidad de mi del inoculo necesaria para iniciar la fermentación de 250 g de nopal (1 x 108 células de K. marxianus, cantidad adecuada para iniciar una fermentación).
Fermentación del nopal con K. marxianus
Se utilizaron 250 g de nopal forrajero picado en pequeños trozos con un molino de cuchillas para alimentos y se introdujeron en matraces de 500 ml, enseguida se añadieron 13 ml de una suspensión de levaduras equivalente a una concentración de 1 x 108 células de K. marxianus (por triplicado por tiempo de fermentación). Inmediatamente el contenido de los matraces se mezclaron para homogenizar el sustrato y la levadura dentro de cada matraz. Los matraces se colocaron en una estufa incubadora con temperatura controlada a 28 °C (temperatura de incubación para K. marxianus) por 24, 48, 72 y 96 h. Al concluir cada periodo de tiempo, las muestras extraídas de la estufa incubadora se secaron a 55 °C por 24 h en una estufa de aire forzado.
Fermentación del nopal con Saccharomyces cerevisiae
En matraces erlenmeyer de 500 mi se colocaron 250 g de nopal forrajero picado y 2.5 g de un producto comercial (Biotecap) elaborado a partir de: a) compuestos propios de la fermentación; b) células de levadura viva (Sacharomyces cerevisiae) y c) oligosacáridos; imánanos y β-glucanos. El nopal se fermentó por periodos de 24, 48, 72 y 96 h a 32°C que es la temperatura ideal para el crecimiento de S. cereviseae.
Una vez concluido el proceso de fermentación, a las muestras de nopal fermentado con ambas levaduras y de los diferentes tiempos se les determinaron los contenidos de materia seca (MS), PC (AOAC, 1994), FDN, FDA y L (Van Soest et al. 1991), así como digestibilidad verdadera in vitro de la MS (DVIVMS) (ANKOM, 2008). La composición química del nopal forrajero es la siguiente: 11.34 % MS 6.7 % PC, 38.2 % FDN, 13.0 % FDA, 3.8 % L y 87.0 % DIVMS.
Análisis Estadístico
Se utilizó un diseño completamente al azar con arreglo factorial 2x5 con mediciones cada 24 horas. Los factores evaluados fueron tipo de levadura (K. marxianus y 5. cerewseae) y tiempos de fermentación (0, 24, 48, 72 y 96 h). El modelo incluyó los efectos de tipo de levadura, tiempos de fermentación y la interacción entre ambos. Como efecto aleatorio se consideró el matraz anidado dentro de tratamiento (tipo de lavadura). Los datos se analizaron con el procedimiento Mixed de SAS (2009).
RESULTADOS
Se observó interacción entre el tipo de levadura x tiempo de fermentación para el contenido de MST, PC y DVIVMS (P < 0.05, Tabla 1); por lo que únicamente se discuten las medias de cada tipo de levadura por tiempo de fermentación. El mayor contenido de PC del nopal fermentado se registró a las 48 h con Sacharomyces cereviciae y fue diferente al contenido de PC con K. marxianus en el mismo tiempo de fermentación (P < 0.001). Después de las 48 h de fermentación, el contenido de proteína mostró una tendencia a disminuir con 5. cerevisiae; mientras que con Kluyveromyces marxianus el contenido de PC en el nopal se incrementó linealmente hasta las 96 h de fermentación. También, el nopal fermentado con S. cerevisiae incrementó la digestibilidad a las 48 h de fermentación y fue igual a la digestibilidad del nopal fermentado con K. marxianus en el mismo tiempo de fermentación (P < 0.05).
La interacción tipo de levadura x tiempo de fermentación fue significativa (Tabla 2, P < 0.05) para los contenidos de FDN, FDA y L. En general con ambas levaduras el contenido de FDN tendió a disminuir a través del tiempo de fermentación. La menor concentración de FDN se observó a las 96 h con K. marxianus y fue diferente al contenido de FDN registrado con S. cerevisiae en el mismo tiempo de fermentación (P < 0.001). De igual manera, el contenido de FDA disminuyó a través del tiempo de fermentación. La menor concentración de FDA se observó a las 96 h con K. marxianus y fue diferente al contenido de FDA registrado con 5. cerevisiae en el mismo tiempo de fermentación (P < 0.001). Por lo que respecta al contenido de lignina, se observó una disminución con S. cerevisiae; mientras que con K. marxianus se incrementó hasta las 72 h de fermentación. El menor contenido de L se registró a las 0 h con K. marxianus y fue diferente a S. cerevisiae en el mismo tiempo de fermentación (P < 0.001), mientras que con S. cerevisieae se observó la menor concentración de L a las 48 h y fue diferente a K. marxianus en el mismo tiempo de fermentación (P < 0.001).
DISCUSIÓN
Materia seca
A pesar de que no se observaron diferencias estadísticas en el contenido de MST (100 °C) con ambas levaduras, numéricamente el contenido de MST obtenido con S. cerevisiae a las 96 h de fermentación fue 2.71 % mayor que la MST registrada con K. marxianus. Esta diferencia en el contenido de MS podría atribuirse al crecimiento de S. cerevisiae en el sustrato (nopal). Esta levadura hace un uso eficiente de los carbohidratos presentes en el nopal cuyo metabolismo produce CO2, H2O y energía en forma de ATP (Sato y Sudo, 1999). Se sabe que el carbono es suministrado por los carbohidratos (Giraldo y López 2008) como los presentes en el nopal, y la concentración de azúcar inicial afecta la velocidad de fermentación, el comportamiento y el desarrollo de las células de la levadura. Debido a que una alta concentración de azúcares (22 %) puede ocasionar una deficiencia respiratoria en la levadura y un descenso en la velocidad de fermentación (Brock 1993).
Proteína cruda
La adición de S. cereviciae incrementó de 6.71 a 14.04 % el contenido de PC a las 48 h de fermentación; mientras que con la adición de K. marxianus se incrementó de 6.71 a 13.64 % a las 96 h. El incremento en el contenido de PC podría deberse tanto a un aumento en la concentración de levaduras como a el contenido de nitrógeno total (orgánico e inorgánico) del nopal debido a que las levaduras no utilizan el nitrógeno del aire (Lañe y Morrissey 2010). De esta manera, un incremento del nitrógeno en el sustrato no ocurre durante el proceso, pero una reducción en el peso del sustrato ocurre debido a la volatilización del CO2 y H2O durante la fermentación. Esto justifica el incremento de la PC (Araujo et al. 2005). Resultados similares a los de este estudio fueron registrados por estos mismos investigadores en nopal fermentado con 5 % de Saccharomices cereviseae a 30 °C de temperatura (14.88 %). No se han reportado valores de PC en nopal fermentado con K. marxianus. Sin embargo, Díaz et al. (2012) reporta un 19.36 % de PC en nopal fermentado a las 12 h con un inoculo de K. lactis, urea, calcio sulfato de amonio y minerales. La diferencia en el incremento en la concentración de proteína en el nopal fermentado con K. marxianus y S. cerevisiae en el tiempo de fermentación para alcanzar la máxima concentración de proteína podría atribuirse a la velocidad de fermentación para alcanzar la fase estacionaria de cada tipo de levadura (K. marxiaus 19 h y S. cerevisiae 24 h, Zumabado et al. 2006). Estos mismos autores mencionan que la fase estacionaria de K. marxianus se alcanza a las 19 h en el suero de leche y alcanza una concentración de proteína de 32 % en la biomasa microbiana. Esto sugiere que K. marxianus emplea la lactosa como sustrato. Sin embargo, el nopal carece de lactosa por lo que se infiere que K. marxianus emplea los azúcares presentes en el nopal de manera más lenta ya que se observa que conforme avanza el tiempo de fermentación la concentración de carbohidratos estructurales en el nopal fermentado disminuye y la concentración de PC incrementa pero sin observar en ninguna de estas variables una concentración constante. Por su parte, S. cerevisiae requiere de 25 h para alcanzar la fase estacionaria, pero utiliza los carbohidratos del nopal de manera más eficiente que K. marxianus pues alcanza una mayor concentración de PC en menor tiempo. Además, la concentración inicial de glucosa en el nopal puede afectar la velocidad de fermentación y por lo tanto la concentración de PC (Liti et al. 2001). Se dice que a niveles mayores de 30 gL-1 se puede manifestar el efecto crabtree negativo en el cual se produce etanol bajo condiciones de O2 limitante y los cul cultivos en matraces se consideran limitados de O2 y por esta razón K. marxianus pudo haber exhibido una larga fase de crecimiento restrictivo asociado a la producción de etanol (Inchaurrondo et al. 1994) y por consecuencia una disminución en la formación de biomasa de forma considerable (Postma et al. 1989).
Digestibilidad de la materia seca
La digestibilidad observada a las 48 h de fermentación tanto con S. cerevisiae como con K. marxianus es de 93 % y es menor a la reportada por Araujo et al. (2005) en Opuntia fiscus enriquecido con S. cerevisiae (95.8 %) y mayor a la registrada por Graciano et al. (2008) en Opuntia fiscus (78 %). El incremento observado en la DVIVMS en este estudio podría estar relacionado con el contenido de azúcares solubles (extracto libre de nitrógeno) y el bajo contenido de FDN y L (Van Soest 1982); es decir, este aumento puede deberse a las propiedades intrínsecas de la pared celular, lo que finalmente define su utilización en la alimentación animal (Buxton y Mertens 1985).
Fibra detergente neutra y Fibra detergente ácido
No existen trabajos que reporten los contenidos de FDN y FDA en nopal fermentado, sin embargo, Pinos et al. (2010) registraron un contenido de 28.8 y 15.4 % de FDN y FDA respectivamente en pencas de Opuntia fiscus-indica de 30 días de edad sin fermentar, los cuales coinciden con los valores encontrados en este estudio en el nopal fermentado con 5. cerevisiae a las 72 h.
La pared celular de las plantas es la fracción insoluble del forraje después de exponerlo al tratamiento con solución detergente neutro. Esta fracción contiene celulosa, hemicelulosa, sílice, proteína indigestible y lignina (Van Soest et al. 1991). La FDN puede representar hasta dos terceras partes de la MS de los forrajes (Jarrige 1988). De acuerdo con Van Soest (1982), los forrajes con un contenido menor a 40 % de FDN pueden considerarse como de buena calidad, mientras que aquellos que sobrepasan el 60 %, pudieran interferir con la digestión y el consumo. Por consiguiente, los niveles de FDN obtenidos en este estudio indican, valores nutritivos adecuados que pueden favorecer el desempeño productivo de los animales que consuman nopal fermentado. Mertens (1994) indica que la fracción de FDA en los forrajes representa la cantidad de fibra indigestible y que valores aproximados al 30 % favorecerían el consumo de MS como los registrados en este estudio.
Lignina
La disminución en la concentración de lignina (L) en el nopal fermentado a las 48 h con 5. cerevisiae podría deberse al efecto de enzimas lignocelulolíticas generadas durante el proceso de fermentación, lo cual sugiere que durante la fermentación se degradó la L. La lignina es un heteropolímero amorfo, tridimensional y ramificado, formado por alcoholes aromáticos que da soporte estructural, rigidez, impermeabilidad y protección a los polisacáridos estructurales (celulosa y hemicelulosa) y es altamente resistente a la degradación química y biológica (Aro et al. 2005).
De acuerdo con los resultados obtenidos se concluye que el nopal fermentado con Sacharomyces cerevisiae incrementa un 54 % el contenido de PC, mientras que con Kluyveromyces marxianus se incrementa en 49 %. Cabe mencionar que el objetivo de la fermentación en estado sólido es efectuar en un solo paso la hidrólisis de los componentes lignocelulolíticos y la fermentación de los azúcares producto de la hidrólisis, lo cual es evidente al observar que el contenido de FDN y FDA del nopal fermentado con K. marxianus tiende a disminuir con el tiempo de fermentación, mientras que con S. cerevisiae se presentó hasta las 96 h de fermentación. Por lo tanto, se podría inferir que existen algunas enzimas producto de la fermentación que degradan la lignina. Las mejores características nutritivas en el nopal fermentado se obtuvieron a las 48 h y 96 h de fermentación con S. cerevisiae y K. marxianus respectivamente. Se recomienda evaluar otros tiempos de fermentación en el nopal cuando se utilice K. marxianus.
LITERATURA CITADA
AOAC (1994) Official Methods of Analysis. Vol II 16th Edition. Association of Official Analytical Chemists International. Gaithersburg, Maryland. Chapter 32: 24-32.
ANKOM Technology (2008) Procedures for fiber and in vitro analysis, https://www.ankom.com/dietary-fiber-analisis.
Araujo LF, Nunes MA, Perazzo NA, Conrado OLS, Da Silva FLH (2005) Protein Enrichment of cactus pear (Opuntia ficus- indica mil) using Sacharomyces cereviseae in solid state fermentation. Brazilian Archives of Biology and Technology. No. especial 48: 161-168.
Aro N, Pakula T, Penttila M (2005) Transcriptional regulation of plant cell wall degradation by filamentous fungi. FEMS Microbiología Revista 29: 719-739.
Buitrago G, Soto L, Páez G, Araujo K, Mármol Z, Rincón M (2008) Continue production of single cell protein of Kluyveromyces marxianus var. Marxian us from diluited cheese whey. Revista Técnica de Ingeniería de la Universidad de Zulia 31: 107-103.
Chávez ML, González Iv, Rodríguez DR, Rodríguez HC, Aguilar N (2009) Aspectos básicos de la fermentación en medio sólido. Ciencia Cierta Revista de Divulgación Científica 20: 7-14.
Brock T (1993) Biología de los microorganismos. Michael Madigan. Info. Agro. http://www.Filecrop.com/microbiología-de-brock-pdf. Accesado 10 abril 2013.
Buxton DR, Mertens, DR (1995) Quality-related characteristics of forages. In: Forages. Volume II. The Science of Grassland Agriculture. Barnes, R.F., Miller, D.A., Nelson, C.J. (Eds). Iowa State University Press. Ames, Iowa. USA. 83-96 pp.
Díaz PD, Rodríguez MC, Mancillas FP, Ruiz ON, Mena MS, Salvador TF, Duran LM (2012) Fermentación in vitro de nopal forrajero con un inoculo de levadura Kluyveromyces lactis obtenida a partir de manzana de deshecho. Revista Electrónica Veterinaria 13: 1-17.
Frazier WC, Westhoff DC (1993) Microbiología de los alimentos, 4a ed., Acribia S.A., Zaragoza, España, pp 41-49.
Giraldo MV, López PL (2008) Producción de proteína unicellular a partir de deshechos agroindustriales. Revista VIRTUALPRO. Bogotá, Colombia. Accesado 17 de enero 2014. www.encontrarmexico.com/Giraldo+MV+lopez+PL+(2008).
Grba ST, Sthelik N, Stanzar N, Vahele N, Skrlin (2002) Selection of yeast strain of Kluyveromyces marxianus for alcohol and biomass production on whey. Chemical and Biochemical Engineering 16 (1): 13-16.
González CP, Díaz FM (2009) Fermentación alcohólica del lactosuero por Kluyveromyces marxianus y solventes orgánicos como extractantes. Revista de la Sociedad Venezolana de Microbiología 29: 110-116.
Graciano FG, Heinzle E, Wittmann C, Gombert AK (2008) The yeast Kluyveromyces marxianus and its biotechnological potential. Applied Microbiology and Bioterchnology 79: 339-354.
Herrera TE, Cerrillo SMA, Juárez RAS, Murillo OM, Ríos RG, Reyes EO, Bernal BH (2010) Efecto del tiempo de cosecha sobre el valor proteico y energético del forraje verde hidropónico de trigo. Revista Interciencia. 4: 35: 284-289.
Inchaurrondo VA, Yantoino OM, Voget GE (1994) Yeast growth and β-galactosidase production during aerobic batch cultures in lactoselimited synthetic médium. Process Biochem pp 29-47.
INEGI (2012) Cuaderno Estadístico Municipal, Durango. Estado de Durango. México, www.inegi.or.mx/dur/poblacion/default.asx?t. Consultado: 30 de abril de 2013.
Jarrige R (1988) Ingestion et digestion des aliments. In: Alimentation des bovins, ovins et caprins. Ed. INRA. Publications, Route de St-Cyr, 78000. Versailles 476 p.
Lane MM, Morressey P (2010) Kluyveromyces marxianus : A yeast emerging from its sister's shadow. British Mycological Society 24: 17-26.
Liti GF, Wardrop G, Cardinali A, Martini G, Walker C (2001) Differential responses to antimycin A and expression of crabttree effect in select Klyuveromyces spp. Annals of Microbiology 51: 235-243.
Mertens DR (1994) Regulation of forage intake. 450-493 pp. In: Fahey Jr. G.C (Ed). Forage quality, evaluation and utilization. Madison, Wl. USA. American Society of Agronomy.
Murillo OM, Herrera TE, Carrete FO, Ruiz B, Serrato JS (2012) Chemical composition, in vitro gas production. Ruminal fermentation and degradation patterns of diets bay grazing in native range of north Mexico. Asian Australasian Journal of Animal Science 25: 1395-1403.
Palmerín CDM, Guevara LO, Villaseñor FO, Pérez PC (2011) Identificación de una levadura para la producción de proteína unicellular para consume humano y determinación de los parámetros cinéticos a nivel de matraces agitados. Revista Ciencia@UAQ 4: 35-46.
Pelaez AA, Meneses MM, Miranda RLA, Ayala MM, Crosby GMM, Loera CO, Megías RDM (2011) Enzimas fibrolíticas producidas por fermentación en estado sólido para mejorar los ensilajes de caña de azúcar. Agrociencia 45: 1405-1422.
Pinos RJM, Velázquez JC, González SS, Aguirre JR, García JC, Álvarez G, Jasso Y (2010) Effects of cladode age on biomass yield and nutritional value of intensively produced spineless cactus for ruminants. South African Journal Animal Science 40(3): 245-250.
Postma E, Verdyn C, Scheffcis W, Van Duken J (1989) Enzymic analysis of the crabtree effect in glucose-limited chemostat cultures of Saccharomyces cereviciae. Applied and Environmental Microbiology 55(2): 468-477.
Rodríguez LGK, Gutiérrez MK, Cárdenas MM, Botello AE, Jiménez IH, Rico MR, Navarrete BJL (2011) Microbial ecology studies of spontaneous fermentation: Starter culture selection for prickly pear wine production. Journal Food Science. 6: 76:346-352.
SAS (2009). SAS User's Guide (Release 9.1): SAS Inst, Inc., Cary, NC.
Sato K, Sudo S (1999) Small Scale solid state fermentation. In: Demain AL, Davies, JE (Eds.) Handbook of industrial microbiology and biotechnology. 2 ed. pp: 61-79.
Van Markis AJA, Abbot DA, Bellissimi E (2006) Alcoholic fermentation of carbon sources in biomass hy-drolysates by Saccharomyces cerevisiae: current status. Antonie Van Leewenhoek 90: 391-418.
Van Soest PJ, Robertson JB, Lewis BA (1991) Methods for dietary fiber, neutral detergent fiber and non starch polysaccharides in relation to animal nutrition: Symposium: Carbohydrate methodology, metabolism and nutritional implications in dairy cattle. Journal Dairy Science. 74:35-83.
Van Soest (1994). Animal ecology of the ruminant USA. 2 ed. Cornell University Press. Ithaca, N.Y. EEUU, p 528.
Zumbado RW, Esquivel RP, Wong GE (2006) Selección de una levadura para la producción de biomasa: Crecimiento en suero de queso. Agronomía Mesoamericana 2: 151-160.