Artículos de revisión
Control integrado de garrapatas en la ganadería bovina
Integrated control of ticks in bovine livestock
*Roger Iván Rodríguez-Vivas, José Alberto Rosado-Aguilar, Melina Maribel Ojeda-Chi, Luis Carlos Pérez-Cogollo, Iris Trinidad-Martínez, Manuel Emilio Bolio-González
Cuerpo Académico de Salud Animal. Facultad de Medicina Veterinaria y Zootecnia. Universidad Autónoma de Yucatán. Km. 15.5 carretera Mérida-Xmatkuil. CP. 97100. Mérida, Yucatán, México. *rvivas@uady.mx
Artículo de revisión recibido: 7 de junio de 2013,
Aceptado: 12 de junio de 2014.
RESUMEN
Las infestaciones de la garrapata del ganado, Rhipicephalus microplus, producen el mayor problema global de ectoparásitos en ganado de regiones tropicales y subtropicales, provocando grandes pérdidas económicas en la producción bovina. El control de R. microplus se basa principalmente en el uso de ixodicidas; sin embargo, su uso irracional ha propiciado la aparición de garrapatas resistentes a las principales familias de ixodicidas. Esto hace necesario el desarrollo de alternativas de control, incluyendo el empleo de prácticas de manejo en los animales, selección de razas de bovinos resistentes a las garrapatas, uso de extractos de plantas, manejo de pastizales, vacunación (vacuna anti-garrapata) y control biológico. El manejo integral de garrapatas consiste en la apropiada combinación de al menos dos herramientas de control para romper el equilibrio de poblaciones con alta proporción de individuos genéticamente resistentes, manteniendo un adecuado nivel de producción en los animales. El objetivo del presente artículo es presentar una revisión actualizada del uso de diferentes manejos de control integrado de garrapatas para el control de R. microplus en la ganadería bovina.
Palabras clave: Garrapatas, ixodicidas, resistencia, control integrado.
ABSTRACT
Infestations with cattle tick, Rhipicephalus microplus constitute the most important ectoparasite problem in the tropical and subtropical regions of the globe, resulting in major economic losses in the cattle production. The control of R. microplus is mostly based on the use of ixodicides. Nevertheless, the irrational use of such products has resulted in tick populations exhibiting resistance to all major ixodicide drug classes. This has urged the development of control alternatives, including the use of animal husbandry practices, selection of tick-resistant cattle breeds, plant extracts, grassland management, vaccination (anti-tick vaccine) and biological control. Integrated tick management consists of the proper combination of at least two control tools aiming to destabilize the constitution of populations with higher proportions of genetically-resistant individuals, while maintaining adequate levels of animal production. The purpose of this paper is to present an updated review on the use of different integrated tick control for the control of R. microplus in the cattle livestock.
Key words: Ticks, ixodicides, resistance, integrated management.
INTRODUCCIÓN
En México se han registrado 82 especies de garrapatas tanto en animales silvestres como domésticos siendo Rhipicephalus microplus la que mayor impacto tiene en la ganadería debido a su amplia distribución en regiones tropicales y subtropicales, a los daños económicos (disminución de los parámetros productivos de los animales y los costos de control), a los problemas de resistencia a ixodicidas, y a las enfermedades que trasmite (Babesia bovis, B. bigemina y Ana plasma marginale) (Rodríguez et al. 2005, Rodríguez-Vivas et al. 2006a,b).
En México los ixodicidas son la estrategia más utilizada para el control de R. microplus (Rodríguez-Vivas et al. 2006a). Estos se aplican sobre el cuerpo de los animales infestados a intervalos específicos determinados por la región ecológica, especies a las que se va a combatir y por la eficacia residual del producto empleado (Rodríguez-Vivas et al. 2005). Los ixodicidas más empleados en México son: organofosforados (OF), piretroides sintéticos (PS) y amitraz (Am) (Rodríguez-Vivas et al. 2006a). Las lactonas macrocíclicas (LM) son endectocidas que también controlan las infestaciones por garrapatas (Rodríguez-Vivas et al. 2010) y han sido usadas en los últimos años en México (Rodríguez-Vivas et al. 2011). Los ixodicidas y LM han sido utilizados con éxito en el control de las garrapatas; sin embargo, su uso constante ha ocasionado la selección de poblaciones resistentes a la acción de los pesticidas (Rodríguez-Vivas et al. 2006a,b, 2007, Pérez-Cogollo et al. 2010, Fernández-Salas et al. 2012). En México existen varios métodos no químicos que se han empleado con éxito para el control de garrapatas (el uso de razas bovinas resistentes a garrapatas, rotación y descanso de praderas, control biológico y vacunas). Sin embargo, el método más promisorio para reducir las poblaciones de garrapatas, es el control integrado de garrapatas. Este control consiste en aplicar sistemáticamente dos o más métodos de control de plagas, que afecten negativamente a una especie hospedadora, disminuyendo el número de aplicaciones de productos químicos y reduciendo los riesgos sobre la salud humana y ambiental (Bram, 1994, Willadsen, 2006). El objetivo del presente artículo es presentar una revisión actualizada del uso de diferentes manejos de control integrado de garrapatas para el control de R. microplus en la ganadería bovina.
IMPORTANCIA DE Rhipicephalus microplus
Las garrapatas son ácaros artrópodos, comprendidas en dos familias: Ixodidae o garrapatas duras y Argasidae o garrapatas blandas (Barker y Murrell 2004). Debido a su gran capacidad de adaptación y propagación las garrapatas del género Rhipicephalus se extienden en diversas áreas geográficas de todo el mundo (Estrada-Peña y Venzal 2006). De las cinco especies que integran a nivel mundial el género Rhipicephalus, R. microplus presenta mayor importancia por su amplia distribución en gran parte de América (excepto Estados Unidos de América, EUA, donde se encuentra erradicado), África, Asia y Australia (Nari y Fiel 1994, Rodríguez-Vivas et al. 2005, Taylor et al. 2007).
Rhipicephalus microplus produce pérdidas relacionadas con mortalidad de los animales, reducción en los niveles de producción, alteraciones reproductivas, altos costos de control, transmisión de diversos agentes patógenos como virus, bacterias, rickettsias y protozoos. Esto puede conducir a enfermedades agudas, crónicas o incluso, a la muerte de los animales (Rodríguez-Vivas et al. 2011). La pérdida de peso de un bovino parasitado por garrapatas del género Rhipicephalus se calcula en 0.26 kg garrapata/año y se ha observado que animales infestados con garrapatas reducen su consumo de alimento (4.37 kg) en comparación con animales no expuestos a garrapatas (5.66 kg). Estos efectos ocasionan pérdidas de varios miles de millones de dólares en la economía pecuaria mundial (Rodríguez-Vivas et al. 2005, Jonsson 2006).
MÉTODOS DE CONTROL DE Rhipicephalus microplus
Control químico
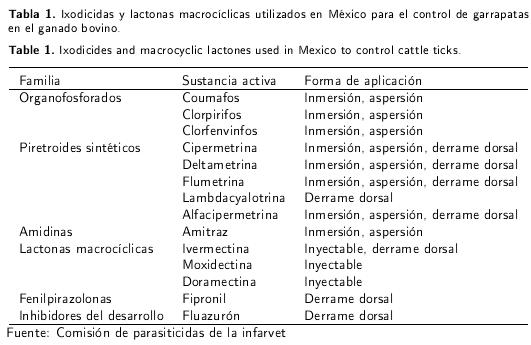
Los métodos de control químico de las garrapatas, tienen como función romper los ciclos de vida de las garrapatas a través de la aplicación de ixodicidas a intervalos determinados por la región ecológica, especies a las que se va a combatir, eficacia residual o persistencia del antiparasitario. En México existen más de 50 productos para el control de garrapatas que incluyen seis grupos distintos con diferencias en sus mecanismos de acción (OF, PS, Am, fenilpirazolonas, reguladores del crecimiento y LM) y que se pueden aplicar por aspersión, inmersión, de forma epicutánea (pour-on) y por vía parenteral (inyectables) (Rodríguez-Vivas et al. 2010). En la Tabla 1 se presenta los ixodicidas y LM utilizados en México para el control de garrapatas en el ganado bovino.

Asimismo, en el mercado internacional se puede encontrar la mezcla de varios ixodicidas que potencializan la acción contra garrapatas. Existen varios OFs que sinergizan la toxicidad de la cipermetrina y deltametrina para el control de R. microplus. En Australia, se ha utilizado con éxito la combinación de ixodicidas tales como cipermetrina + clorfenvinfos y deltametrina + etión (George et al. 2004). En una investigación realizada entre productores bovinos del estado de São Paulo, Brasil, se reportó que el 30.2 % de los productores usaron mezclas de OF-PS para el control de garrapatas (Mendes et al. 2011). En México, existen mezclas de ixodicidas disponibles en el mercado nacional y una de las principales es la mezcla de cimiazol + cipermetrina (Rodriguez-Vivas et al. 2006a, b). Una de las ventajas de esta mezcla de ixodicidas es que se puede combatir garrapatas y moscas al mismo tiempo; sin embargo, el riesgo de generar poblaciones de garrapatas resistentes a los ixodicidas es mayor, por lo que su uso debe ser mediante esquemas establecidos.
Por otro lado, se ha reportado que las LM tiene un impacto ambiental negativo ya que se ha demostrado que en ranchos tratados con LM disminuye la diversidad y abundancia de las poblaciones de escarabajos estercoleros (Basto-Estrella et al. 2011). El uso indiscriminado de estos productos ha provocado la selección de poblaciones de garrapatas resistentes, debido a la fuerte presión que elimina a los individuos susceptibles, disminuyendo progresivamente el efecto y elevando los costos de desarrollo de nuevos ixodicidas (Rodríguez-Vivas et al. 2006a, 2007). En el sureste de México Rodríguez-Vivas et al. (2006a) reportaron que la mayoría de los ranchos estudiados presentaban poblaciones de garrapatas con resistencia múltiple a ixodicidas (principalmente multiresistencia a OFs-PSs-Am). La resistencia de R. microplus a los PSs fue la más importante, ya que del 66 al 95 % de los ranchos en el sureste de México presentan garrapatas resistentes a deltametrina, flumetrina y cipermetrina. Perez-Cogollo et al. (2010) y Miller et al. (2013) reportaron en México los primeros casos de R. microplus resistente a ivermectina y fipronil respectivamente. Recientemente, Fernandez-Salas et al. (2012) reportaron ranchos multiresistentes a OFs, AMs y LMs en el Estado de Veracruz. Estos reportes ponen de manifiesto la necesidad de buscar nuevas alternativas de control de garrapatas, para reducir el uso de ixodicidas y retrasar el proceso de selección de poblaciones de garrapatas resistentes a los productos químicos.
Uso de químicos naturales de plantas
Un método de control químico natural de garrapatas se basa en el uso de extractos de plantas. Sardá-Ribeiro et al. (2007) estudiaron la eficacia de extractos de plantas (Calea serrata), para el control de R. microplus y R. sanguineus, obteniendo una reducción del 11 al 14 % en la oviposición y 100 % de mortalidad en larvas de R. microplus y R. sanguineus, a una concentración de 50, 25, 12.5 y 6.25 mg ml-1. En Colombia, Neira et al. (2009) evaluaron el efecto de la tintura de tabaco (Nicotiana tabacum) en el control de la garrapata en caninos frente al tratamiento clásico con amitraz y los resultados de efectividad obtenidos fueron de un 70 % para larvas, 61.79 % en ninfas y 64.9 % para adultos a una concentración de 0.0117 % de nicotina comparados con un 92 % de efectividad promedio del amitraz en los tres estados larvas, ninfas y adultos. También se ha reportado que los extractos metanólicos de hojas y corteza de Neem (Azadirachta indica) son eficaces para el control de garrapatas (Pathak et al. 2004). Asimismo los aceites de Azadirachta indica y Ocimum han mostrado eficacia como ixodicidas y poseen propiedades repelentes contra larvas de Amblyomma variegatum y todos los estadios de Hyalomma anatolicum excavatum y R. appendicular (Ndumu et al. 1999, Kaaya y Hassan 2000).
En México, Rosado-Aguilar et al. (2010a,b) evaluaron la eficacia de 45 extractos metanólicos de plantas en larvas de R. microplus reportando eficacias de 5-99 %; y en adultas (utilizando los extractos de Petiveria alliacea) reportaron un 86 % de eficacia y un 91 % de reducción en el índice de eficiencia reproductiva. Además, en estos extractos se identificaron, mediante cromatografía de gases, al benciltrisulfuro y bencildisulfuro como los posibles compuestos responsables del efecto ixodicida. Martinez-Velázquez et al. (2011a) reportaron 100 % de eficacia para el control de larvas usando aceites esenciales extraído de Cuminum cyminum y Pimenta dioica. Martinez-Velázquez et al. (2011b) estudiaron el efecto acaricida de aceites esenciales de hojas de orégano (Lippia graveolens), hojas de romero (Rosmarinus officinalis) y bulbos de ajo (Allium sativum) encontrando eficacias de 85 a 100 % contra larvas de R. microplus. Asimismo, Fernández-Salas et al. (2011) reportaron que cuatro plantas tropicales ricas en taninos fueron eficaces en el control de larvas de R. microplus y confirmaron la participación de los taninos en el efecto ixodicidas mediante el uso de inhibidores específicos.
Hasta la fecha, el uso de extractos de plantas para el control de R. microplus en México ha tenido resultados importantes; sin embargo, es necesario estudiar algunos aspectos relacionados con la variación de los metabolitos secundarios en las plantas a través del año, aislar y evaluar los metabolitos activos, así como realizar estudios in vivo.
Control no químico
Dentro de los principales métodos de control no químico de R. microplus se encuentran:
Selección de hospederos resistentes. Las razas Bos indicus son más resistentes a las garrapatas que las razas B. taurus. Jonsson (2006) menciona que en ganado B. indicus presenta del 10 al 20 % menos garrapatas que el ganado B. taurus. La resistencia a las garrapatas varía en relación al sexo, edad, estado de gestación y lactación y temporada del año (Utech et al. 1978). El uso de ganado resistente a las garrapatas se puede lograr por la selección de animales que presenten menos garrapatas, y su posterior cruzamiento con otros animales con la misma característica, así como introducir sangre cebú en el hato (Rodríguez-Vivas et al. 2005). En cruzas de ganado B. indicus la heredabilidad del número de garrapatas R. microplus es alta (h2= 0.34), el total de la proporción de la variación genotípica se debe al efecto aditivo de los genes (Mackinnon et al. 1991).
Introducción de depredadores naturales. En México y en América Latina existen algunas garzas y pájaros que son depredadores naturales de garrapatas. También existen algunas especies de hormigas con efecto depredador en la población de garrapatas (Wilkison 1970, Verrisimo y Machado 1995, Ojeda-Chi et al. 2011).
La rotación, descanso y quema de praderas. El sistema de rotación se basa en descansos obligados de las praderas con la finalidad de presionar a las garrapatas en su etapa de vida libre al impedir o retardar que como larvas activas encuentren a su hospedero para que mueran por hambre y deshidratación (Wilkinson 1970). Furlong (1998) reportó que el tiempo de descanso para reducir el número de larvas presentes de las praderas debe ser de 45-60 d. En Venezuela el empleo de la modelación por computadora permitió predecir que al emplear una rotación de praderas de 36 d de descanso en época de secas y 24 d en épocas lluvias permite una reducción sustancial de las infestaciones de garrapata
El fuego afecta directamente a las garrapatas por la exposición que sufren a las altas temperaturas los estadios de larvas, las hembras adultas y los huevos (Rodríguez-Vivas et al. 2005). Indirectamente tiene un efecto por la destrucción de la capa de vegetación que le sirve de protección a las garrapatas (FAO 2005). Sin embargo, en California, EUA se realizó un estudio para evaluar el efecto del fuego sobre las poblaciones de garrapatas; los autores concluyeron que a pesar de las quemas prescritas en los hábitats no se traduce en una disminución de la abundancia de adultos ixódidos sobre la vegetación y al parecer no afecta a las garrapatas argásida e ixódidas que se refugian en suelo (Padgett et al. 2009).
La composición y tipo de vegetación. Tiene un efecto directo en la sobrevivencia de las garrapatas repletas, huevos y larvas. Las praderas con alta vegetación y arbustos proporcionan a las garrapatas un hábitat ideal para su desarrollo (Rodríguez-Vivas et al. 2005). Existen leguminosas con capacidad para atrapar larvas, mediante pelos y secreciones glandulares viscosas presentes en sus hojas y que tienen la capacidad de inmovilizar entre un 12-27 % de larvas de R. microplus (Wilson et al. 1989). En México, se ha evaluado el efecto de las gramíneas forrajeras: Melinis minutiflora y Andropogon gayanus, las cuales poseen la capacidad de repeler, atrapar u obstaculizar a las garrapatas que buscan hospedero; siendo la primera más eficaz para su control; este tipo de plantas, cultivadas en potreros estratégicamente utilizados, puede reducir el riesgo del encuentro garrapata-bovino y así contribuir a disminuir el uso de ixodicidas (Cruz-Vazquez y Fernandez-Ruvalcaba 2000, Fernandez-Ruvalcaba et al. 2004).
Control biológico. Los agentes biológicos que potencialmente pueden ser usados para el control de garrapatas se clasifican en hongos entomopatógenos (Metarhizium sp; Beauveria sp), bacterias (Cedecea lapagei, Escherichia coli y Enterobacter aglomerans), nematodos entomopatógenos (Heterorhabditidae y Steinernematidae) y hormigas reguladoras (Solenopsis germinata, S. saevissima, Camponotus rengira y Ectatomma cuadridens) (Ojeda-Chi et al. 2011). Todos estos agentes afectan principalmente los estadios de vida libre de las garrapatas (Fernandes et al. 2012). Entre los hongos entomopatógenos M. anisopliae ha sido evaluado ampliamente para el control de R. microplus, ya sea, sobre el animal o aplicado en pasturas (Ojeda-Chi et al. 2011). En los últimos cuatro años se han desarrollado unos 171 micopesticidas, alrededor del mundo, de los cuales únicamente tres productos contienen M. anisopliae para el control de garrapatas (Fernandes et al. 2012). En México las cepas Ma34 y Mal4 han demostrado altas eficacias para el control del R. microplus a nivel de campo (larvas en pasto y garrapatas adultas en bovinos) (Alonso-Díaz et al. 2007, Ojeda-Chi et al. 2010). Por otra parte, se ha empleado la nanotecnología para desarrollar formulaciones fúngicas, por ejemplo, la microencapsulación de las conidias para protegerlas de las condiciones climáticas adversas (radiación solar, temperatura, humedad, etc.) e incrementar su eficacia (Fernandes et al. 2012).
Vacunas. Actualmente se cuenta comercialmente con dos vacunas contra R. microplus denominadas TickGARDPLUS-® en Australia y Gavac™ en América Latina. Las vacunas contienen el antígeno Bm86 que es una glicoproteína aislada de R. microplus que se encuentra predominantemente en las células del intestino de la garrapata. El gen Bm86 de R. microplus se expresa en los huevos pocos días después de la oviposición, en las larvas sin alimentarse y alimentadas, ninfas y machos y hembras adultas (Nijhof et al. 2009). Asimismo, el antígeno Bm86 ha sido expresado en los ovarios de las garrapatas adultas hembras y los estudios de silenciamiento revelan que el Bm86 juega un papel importante durante el período de alimentación y digestión de la sangre en garrapatas hembras de R. microplus repletas alimentadas de bovinos infectados con Babesia bovis (Bastos et al. 2010). Los anticuerpos anti-Bm86 aparentemente se unen a la superficie de las células epiteliales del intestino de la garrapata e interrumpen la endocitosis causando la lisis de las células y reduciendo
Los efectos de la vacuna sobre la garrapata R. microplus son reducciones de la capacidad reproductiva (50-90 %), del número de garrapatas repletas (20-30 %), del peso de las garrapatas (30 %) y del peso de los huevos (60-80 %), sin embargo no produce mortalidad (Jonsson et al. 2000; De la Fuente et al. 2007). También se ha demostrado que es eficaz contra otros géneros y especies de garrapatas tales como B. annulatus, B. decoloratus, H. anatolicum y H. dromedarii (De la Fuente et al. 2007). Se ha sugerido que el efecto de la vacuna (Bm86) se podría incrementar con la inclusión de otros antígenos efectivos o por el uso de adyuvantes. Recientemente Cunha et al. (2012) probaron el antígeno rBm86-CG para el control de R. microplus y reportaron 31 % de eficacia para el control de esta garrapata; los autores concluyeron que este antígeno se podría emplear en una vacuna polivalente como parte de un programa integral para el control de R. microplus.
En un estudio controlado realizado en Brasil, Andreotti (2006) inmunizó bovinos con las vacunas TickGARDPLUS-® y Gavac™ y desafió a los animales usando la cepa brasileña Campo Grande de R. microplus y encontró una eficacia de 46.4 % y 49.2 %, respectivamente. Esta variación en la eficacia de las vacunas disponibles se debe a varios factores tales como al sistema de expresión usado para la producción de la vacuna, características de la población de garrapatas a controlar, y factores del hospedero (Parizi et al. 2009). Se ha sugerido que la variación en la secuencia del locus de Bm86 (> 3 % en la secuencia de aminoácidos) es una de las razones principales para que en ciertas poblaciones de R. microplus las vacunas comerciales tengan poca eficacia (García-García et al. 2000).
Hajdusek et al. (2010) evaluaron la eficacia de la proteína Ferritina 2 para el control de garrapatas. Las proteínas ferritinas de tipo recombinantes de Ixodes ricinus (lrFER2) y R. microplus (RmFER2) fueron expresadas en Escherichia coli y usadas para inmunizar conejos y bovinos, respectivamente. La lrFER2 redujo el número de garrapatas, peso y fertilidad de I. ricinus en conejos con una eficacia general de 98 %. La eficacia general (RmFER2) para el control de infestaciones de R. microplus y R. annulatus en bovinos vacunados fue de 64 y 72 %, respectivamente. La eficacia de la vacuna RmFER2 fue similar a la obtenida con la vacuna Bm86 para el control de R. microplus.
Recientemente, Guerrero et al. (2011) analizaron el genoma de R. microplus y seleccionaron dos nuevos antígenos que al ser inoculados a bovinos en condiciones controladas se observó > 70 % de mortalidad en garrapatas R. microplus. Ante este hallazgo, se hace necesario probar estos antígenos en condiciones de campo con la intención de producir una vacuna más eficiente que las disponibles de forma comercial.
CONTROL INTEGRADO DE GARRAPATAS
Consideraciones en el uso de ixodicidas. A pesar de que los OFs han sido usados por muchos años para el control de garrapatas en México, el problema de la resistencia es todavía manejable, principalmente con el uso del coumafos y clorfenvinfos (prevalencias < 50 %) (Rodríguez-Vivas et al. 2006a). En cuanto al uso de amitraz, se han realizado estudios en el sureste de México que sugieren que la resistencia que presenta todavía puede ser manejable, ya que se ha reportado índices de Resistencias bajos (IR: 2-23) (Rosado-Aguilar et al. 2008). Sin embargo, el aumento de cepas resistentes a los diferentes ixodicidas, crea la necesidad de implementar estrategias de control basadas en un manejo integral de garrapatas que reduzcan la probabilidad de que emerjan nuevas cepas en campo o que las ya existentes tengan un manejo más eficaz de ixodicidas.
Estudios sobre el control integrado de garrapatas. El control integrado de garrapatas (CIG) consiste en la asociación del medio ambiente y la dinámica de población de las especies de plagas, utilizando una combinación de técnicas y métodos sustentables que sean compatibles y que mantengan niveles bajos de las poblaciones de plagas que causan pérdidas económicas (Rodríguez-Vivas et al. 2011). Este manejo combina adecuadamente varias herramientas de control a efectos de desestabilizar la formación de aquellas poblaciones con mayor proporción de individuos genéticamente resistentes, manteniendo un nivel adecuado de producción (Solari et al. 2007). El CIG generalmente se asocia a una drástica disminución de la frecuencia de tratamientos. Para prevenir y manejar la resistencia, no sólo es suficiente disminuir la dependencia a los ixodicidas, sino también utilizarlos en épocas/momentos/animales de tal forma que no aumenten la presión de selección genética (Rodríguez-Vivas et al. 2005).
Para poder realizar un manejo efectivo de las poblaciones de las garrapatas, minimizar sus efectos y preservar los ixodicidas disponibles, se debe emplear un control integrado de garrapatas. La mayoría de las herramientas disponibles para alcanzar estos objetivos se encuentran disponibles e incluye herramientas y técnicas auxiliares de control, tales como técnicas moleculares, la distribución espacial de la garrapata y de las poblaciones resistentes, simulación de modelos, imágenes satelitales, vacunas, prácticas agronómicas (razas resistentes, rotación de potreros) y control biológico (hongos entomopatógenos, bacterias, depredadores, parasitoses, etc.).
En la Tabla 2, se resume las principales estrategias de control integrado aplicado en varios países para el control de las garrapatas en la ganadería bovina. En estudios de laboratorio efectuados por Bahiense et al. (2006) evaluaron la asociación de deltametrina y el hongo entomopatógenos M. anisopliae contra larvas resistentes a PSs de R. microplus, observando altas mortalidades. Los autores concluyeron que esta asociación puede ser utilizada como una herramienta para el CIG de R. microplus. Asimismo, Bahiense et al. (2008) evaluaron la combinación de deltametrina y M. anisopliae en becerros infestados artificialmente con garrapatas R. microplus y reportaron un 30.2 % de eficacia para el control de esta garrapata y 60 % de reducción en la oviposición de las mismas.
Por otra parte, Farenhorst et al. (2010) evaluaron la combinación de los hongos Beauveria bassiana y M. anisopliae con permetrina para el control del mosquitos Anopheles gambiae. Estos autores reportaron un efecto sinérgico entre los hongos y la permetrina, de 60-70 % de mortalidad para M. anisopliae y B. bassiana respectivamente, en comparación del grupo tratado solo con permetrina (10-20 % de mortalidad). Estos resultados demuestran que los hongos se pueden emplear en el CI. Además M. anisopliae presenta alta eficacia para el control a nivel de campo. Ojeda-Chi et al. (2010) reportaron que Ma34+Ma 14 tuvieron un 64-100 % de eficacia en control en praderas infestadas con larvas de R. microplus y un 35-55 % de reducción en el índice de eficiencia reproductiva; Alonso-Díaz et al. (2007) reportaron 40-90 % de eficacia para el control de bovinos infestados naturalmente. Estos resultados demuestran que M. anisopliae se puede emplear en combinación con otros métodos de control para reducir el número de aplicaciones de ixodicidas y permitir alargar la vida útil de los ixodicidas.
En México, la combinación de la vacuna Gavac™ e ixodicidas para el control de R. microplus ha sido usado con buenos resultados. Redondo et al. (2004) en condiciones de campo lograron casi el 100 % de control de poblaciones R. microplus resistentes a PS, cuando se utilizó la vacuna Gavac en combinación con tratamientos de Am. Asimismo, de la Fuente et al. (2007) reportan un rancho donde se usó este manejo integral de garrapatas durante 10 años y se logró reducir los tratamientos ixodicidas de 24 a 7-8 por año y reducir el número de garrapatas adultas promedio de 100 a 20 por animal. En Cuba, se empleó la vacuna Gavac en animales de producción infestados con R. microplus y se redujo en 87 % el empleo de tratamientos ixodicidas, adicionalmente se redujo de 54 a 1.9 los casos clínicos de Babesiosis (Rodriguez-Valle et al. 2004).
En Uruguay, Solari et al. (2007) realizaron un control integrado de parásitos mediante el uso de ivermectina, ixodicidas y vacuna contra hemoparásitos. En este estudio se comprobó el beneficio que se logra con el uso del control integrado al reducir el número de garrapatas, casos clínicos de hemoparásitos y moscas hematófagas. Se encontró una diferencia favorable a la aplicación del CIG debido a una disminución en las muertes por hemoparásitos y a un menor número de tratamientos, pasando de $ 6 451 USD correspondiente al período histórico (de 2003 a 2005 sin el uso del CIG) a $ 4 163 USD del período cuando se usó el CIG (de 2005 a 2007). En este estudio existieron además otros beneficios relacionados al estrés por menor movimiento del ganado, lo cual fue difícil de cuantificar.
Otra estrategia es el uso de mezclas de ixodicidas y sinergistas. Los principales sinergistas que se han usado como potencializadores de acción de los ixodicidas para el control de garrapatas son: trifenilfosfato (un inhibidor de la esterasas), butóxido de piperonilo (PBO) (un inhibidor del citocromo P450 monooxigenasas), dietil maleato (un inhibidor del glutation-S-trasferasas) y verbutina (un inhibidor de ciertas isoformas del citocromo P450) (Li et al. 2007). Li et al. (2010) demostraron que el uso de PBO y verbutina potencializan la acción de la permetrina, coumafos y amitraz. La verbutina demostró mayor sinergismo que el PBO para controlar larvas de R. microplus resistentes al coumafos (índice de sinergismo, IS = 1.5-6.0 vs. 0.9-1.6) y amitraz (IS = 1.8-1.5 vs. 0.9-2.5), pero similar sinergismo para la permetrina (IS = 2.1-4.4 vs. 2.13.6).
Recientemente, Miller et al. (2012) evaluaron como parte del CIG, el uso de modelos computacionales (herramienta adicional) para la aplicación estratégica de la vacuna Bm86 en el control de R. annulatus para la erradicación de garrapatas en EUA. Estos autores reportaron 99.0 % de eficacia de R. annulatus a los 55 días PT; asimismo, emplearon los modelos computacionales para predecir el efecto de la inmunización con una vacuna Bm86 en poblaciones de garrapatas y reportaron que el uso de la vacuna mantendrá sosteniblemente la erradicación de R. annulatus en la zona de cuarentena permanente de EUA.
En la Figura 1 se presenta un esquema del control integrado de garrapatas (R. microplus) propuesto para la ganadería bovina de la península de Yucatán. En el esquema se propone aplicar ixodicidas (amitraz o un organofosforado) en los meses de abril y mayo. En el mes de junio se propone aplicar un organofosforado o piretroide para el control de garrapatas y simultáneamente para controlar moscas hematófagas lo que coincide con el inicio del período de lluvias y el aumento en el número de los dípteros hematófagos. En los meses de julio y octubre se propone aplicar una LM de corta acción (1 % de concentración), con la intención de controlar simultáneamente garrapatas y nematodos gastrointestinales; meses donde se han encontrado las más altas poblaciones de nematodos gastrointestinales de los géneros Haemonchus y Trichostrongylus en bovinos de la península de Yucatán, México (Domínguez-Alpizar et al. 1993). Es recomendable que en el mes de julio se aplique preferentemente moxidectina ya que en este mes del año es cuando existe una alta población de escarabajos estercoleros en Yucatán (Basto-Estella et al. 2011) y se ha observado que esta LM presenta pocos o nulos efectos contra estos insectos cuando es eliminado en las heces de los bovinos tratados (Lumaret et al. 2012).
De septiembre a noviembre se propone aplicar cada 15 días el hongo M. anisopliae en praderas con altas infestaciones de garrapatas según la metodología propuesta por Ojeda-Chi et al. (2010). Asimismo, en el mes de diciembre cuando las cargas parasitarias de garrapatas se encuentran bajas en los bovinos (< 30 garrapatas R. microplus adultas por animal) se recomienda el uso del fluazurón o el inicio de la aplicación de la vacuna Gavac®. El esquema de vacunación con Gavac® en México recomendado por el fabricante es la aplicación de una dosis los días 0, 32, 55 y 122, para posteriormente revacunar cada 6 meses. Con este esquema propuesto se pretende reducir el número de aplicaciones de productos químicos para el control de parásitos, retardar la selección de poblaciones de garrapatas, moscas y nematodos gastrointestinales resistentes a los antiparasitarios, así como reducir los riesgos sobre la salud humana y ambiental.
Existen muchos trabajos que demuestran que el CIG es la mejor opción para aumentar la capacidad productiva de los animales; sin embargo, los parásitos internos y externos de los rumiantes se presentan en condiciones naturales de forma simultánea, por lo cual es necesario el control integrado de ambas clases de parásitos. El reto principal que existe a nivel mundial y en especial en México es el uso eficiente de un programa integrado de parásitos en la ganadería (al menos que controle garrapatas, nematodos gastrointestinales y moscas hematófagas) mediante la implementación de diferentes estrategias de control químico y no químico.
LITERATURA CITADA
Alonso-Díaz MA, García L, Galindo-Velasco E, Lezama-Gutiérrez R, Angel-Sahagún C, Rodríguez-Vivas RI, Fragoso-Sánchez H (2007) Evaluation of Metarhizium anisopliae (Hyphomycetes) for the control of Boophilus microplus (Acari: Ixodidae) on naturally infested cattle in the Mexican tropics. Veterinary Parasitology 147: 336-340.
Andreotti R (2006) Performance of two Bm86 antigen vaccine formulation against tick using crossbreed bovines in stall test. Revista Brasileira de Parasitologia Veterinaria 15(3): 97-100.
Bahiense TC, Fernandes EKK, Angelo Ida C, Perinott WMS, Bittencourt VREP (2008) Performance of Metarhizium anisopliae and its combination with deltamethrin against a pyrethroid-resistant strain of Boophilus microplus in a stall test. Animal biodiversity and emerging diseases: Annals of the New York of the Academic Science 1149: 242-245.
Bahiense TC, Fernandes EKK, Bittencourt VREP (2006) Compatibility of the fungus Metarhizium anisopliae and deltamethrin to control a resistant strain of Boophilus microplus tick. Veterinary Parasitology 141: 319-324.
Barker SC, Murrell A (2004) Systematic and evolution of ticks with a list of valid genus and species names. Parasitology 129: 15-36.
Basto-Estrella GS, Rodriguez-Vivas RI, Delfin-Gonzalez H, Reyes-Novelo E (2011) Escarabajos estercoleros (Coleóptera, Scarabaeidae, Scarabaeinae) de ranchos ganaderos de Yucatán, México. Revista Mexicana de Biodiversidad 83: 380-386.
Bastos RG, Ueti MW, Knowles DP, Scoles GA (2010) The Rhipicephalus (Boophilus) microplus Bm86 gene plays a critical role in the fitness of ticks fed on cattle during acute Babesia bovis infection. Parasitises Vectors 3: 1-11.
Bram RA (1994) Integrated control of ectoparasites. In: Ectoparasites of animals and control methods. Revue scientifique et technique (International Office of Epizootics) 13: 1357-1365.
Cruz-Vazquez C, Fernandez-Ruvalcaba M (2000) Anti-tick repellent effect of Andropogon gayanusgrass on plots of different ages experimentally infested with Boophilus microplus larvae. Parasitología al día 248: 3-4.
Cunha RC, Pérez de León AA, Leite FP, Pinto Lda S, Dos Santos Júnior AG, Andreotti R (2012) Bovine immunoprotection against Rhipicephalus (Boophilus) microplus with recombinant Bm86-Campo Grande antigen. Brazilian Journal of Veterinary Parasitology 21(3): 254-62.
De la Fuente J, Almazan C, Canales M, Perez de la Lastra JM, Kocan KM, Willadsen P (2007) A ten-year review of commercial vaccine performance for control of tick infestations on cattle. Animal Health Research Reviews 8-(1): 23-28.
Domínguez J, Rodríguez VRI, Honhold N (1993) Epizootiología de los parásitos gastrointestinales en bovinos del estado de Yucatán. Veterinaria México 24(3): 189-193.
Estrada-Peña A, Venzal M (2006) High resolution predictive mapping for Boophilus annulatus and Boophilus microplus (Acari:Ixodidae) in Mexico and Southern Texas. Veterinary Parasitology 142: 350-358.
FAO (2005) Integrated control programs for ticks on cattle: an examination of some possible components. 43-61 pp.
Farenhorst M, Knols BGJ, Thomas MB, Howard AFV, Takken W, Rowland M, NGuessan R (2010) Synergy in efficacy of fungal entomopathogens and permethrin against West African insecticide-resistant Anopheles gambiae mosquitoes. PLoS One 5 (8): e12081.
Fernandes EKK, Bitencourt VREP, Roberts DW (2012) Perspectives on the potential of entomopathogenic fungi in biological control of tick. Experimental Parasitology 130: 300-305.
Fernandez-Ruvalcaba M, Preciado-de la Torre F, Cruz-Vazquez C, Garcia-Vazquez Z (2004) Anti-tick effects of Melinis minutiflora and Andropogon gayanus grasses on plots experimentally infested with Boophilus microplus larvae. Experimental and Applied Acarology 32: 293-299.
Fernandez-Salas A, Alonso-Diaz MA, Acosta-Rodriguez R, Torres-Acosta F, Sandoval-Castro C, Rodriguez-Vivas RI (2011) In vitro acaricidal effect of tannin-rich plants against the cattle tick Rhipicephalus (Boophilus) microplus (Acari: ixodidae). Veterinary Parasitology 175(1-2): 113-118.
Fernandez-Salas A, Rodriguez-Vivas RI, Alonso-Diaz MA (2012) First report of a Rhipicephalus microplus tick population multi-resistant to acaricides and ivermectin in the Mexican tropics. Veterinary Parasitology 186: 338-342.
Furlong J (1998) Poder infestante de larvas de Boophilus microplus (Acari:Ixididae) em pastagem de Melinis minotiflora, Brachiaria decumbens e Brachiaria mutica. Ciencia Rural, Santa Maria 28 (4): 635-648.
García-García JC, Montero C, Redondo M, Vargas M, Canales M, Boue O, Rodríguez M, Joglar M, Machado H, González IL, Valdés M, Méndez L, de la Fuente J (2000) Control of ticks resistant to immunization with Bm86 in cattle vaccinated with the recombinant antigen Bm95 isolated from the cattle tick Boophilus microplus. Vaccine 18(21): 2275-2287.
George JE, Pound JM, Davey RB (2004) Chemical control of ticks on cattle and the resistance of these parasites to acaricides. Parasitology 129: S353-S366.
Guerrero F, Andreotti R, Perez de Leon A, Moolhuijzen P, Rodriguez-Valle M, Bellgard M (2011) Genome-based selection of anti-cattle tick vaccine candidate antigens. Ticks and tick-borne pathogens, International Conference: Zaragoza, Spain, pp: 9-11.
Hajdusek O, Almazán O, Loosova G, Villar M, Canales M, Grubhoffer L, Kopacek P, de la Fuente J (2010) Characterization of ferritin 2 for the control of tick infestations. Vaccine 28: 2993-2998.
Jonsson N (2006) The productivity effects of cattle tick (Boophilus microplus) infestation on cattle, with particular reference to Bos indicus cattle and their crosses. Veterinary Parasitology 137: 1-10.
Jonsson NN, Matschoss AL, Pepper P, Green PE, Albrecht MS, Hungerford J, Ansell J (2000) Evaluation of tick-GARD (PLUS), a novel vaccine against Boophilus microplus, in lactating Holstein-Friesian cows. Veterinary Parasitology 88: 275-285.
Kaaya GP, Hassan S (2000) Entomogenous fungi as promising biopesticides for tick control. Experimental and Applied Acarology 24: 913-926.
Li AY, Chen AC, Davey RB, Miller RJ, George JE (2007) Acaricide resistance and synergism between permethin and amitraz against susceptible and resistant strains of Boophilus microplus (Acari: Ixodidae). Pest Management Science 63: 882-889.
Li AY, Davey RB, Miller RJ (2010) Laboratory evaluation of Verbutin as a synergist of acaricides against larvae of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Journal of Economic Entomology 103(4): 1360-1364.
Lumaret JP, Errouissi F, Floate KD, Römbke J, Wardhaugh KG (2012) A review on the toxicity and non-target effects of macrocyclic lactones in terrestrial and aquatic environments. Current Pharmaceutical Biotechnology 13: 1004-1060.
Mackinnon MJ, Meyer K, Hetzel DJS (1991) Genetic variation and covariation for growth, parasite resistance and heat tolerance in tropical cattle. Livestock Production Science 27: 105-122.
Martinez-Velazquez M, Castillo-Herrera GA, Rosario-Cruz R, Flores-Fernandez JM, Lopez-Ramirez J, Hernandez-Gutierrez R, Lugo-Cervantes EC (2011a) Acaricidal effect and chemical composition of essential oils extracted from Cuminum cyminum, Pimenta dioica and Ocimum basilicum against the cattle tick Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Parasitology Research 108(2): 481-487.
Martinez-Velazquez M, Rosario-Cruz R, Castillo-Herrera G, Flores-Fernandez JM, Alvarez AH, Lugo-Cervantes E (2011b) Acaricidal effect of essential oils from Lippia graveolens (Lamíales: Verbenaceae), Rosmarinus officinalis (Lamíales: Lamiaceae), and Allium sativum (Liliales: Liliaceae) Against Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Journal of Medical Entomology 48(4): 822-827.
Mendes MC, Lima CK, Nogueira AH, Yoshihara E, Chiebao DP, Gabriel FH, Ueno TE, Namindome A, Klafke GM (2011) Resistance to cypermethrin, deltamethrin and chlorpyriphos in populations of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) from small farms of the State of São Paulo, Brazil. Veterinary Parasitology 178: 383-388.
Miller R, Estrada-Peña A, Almazán C, Allen A, Jory L, Yeater K, Messenger M, Ellis D, Pérez de León AA (2012) Exploring the use of an anti-tick vaccine as a tool for the integrated eradication of the cattle fever tick, Rhipicephalus (Boophilus) annulatus. Vaccine 30(389): 5682-5687.
Miller RJ, Davey RB, George JE, Perez de Leon A (2013) First report of resistance to fipronil in Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) of Mexico. Journal of Medical Entomology 191: 97-101.
Nari A, Fiel C (1994) Enfermedades parasitarias de importancia económica en bovinos. Bases epidemiológicas para su prevención y control. Editorial Hemisferio sur. pp: 289-299.
Ndumu PA, George JPD, Choudhury MK (1999) Toxicity of neem seed oil (Azadirachta indica) against the larvae of Amblyomma variegatum, a three-host tick in cattle. Phytotherapy Research 13: 532-534.
Neira J, Carvajal L, Cala F, Gómez J (2009) Evaluación del efecto de la tintura de tabaco (Nicotiana tabacum) en el control biológico de La garrapata. Revista Colombiana de Ciencias Pecuarias. 3(22): 551-552.
Nijhof AM, Balk JA, Postigo M, Jongejan F (2009) Selection of reference genes for quantitative RT-PCR studies in Rhipicephalus (Boophilus) microplus and Rhipicephalus appendiculatus ticks and determination of the expression profile of Bm86. BMC Molecular Biology 10: 112.
Ojeda-Chi MM, Rodriguez-Vivas RI, Galindo-Velasco E, Lezama-Gutierrez R (2010) Laboratory and field evaluation of Metarhizium anisopliae (Deuteromycotina: Hyphomycetes) for the control of Rhipicephalus microplus (Acari: Ixodidae) in the Mexican tropics. Veterinary Parasitology 170: 348-354.
Ojeda-Chi MM, Rodriguez-Vivas RI, Galindo-Velasco E, Lezama-Gutiérrez R, Cruz-Vázquez R (2011) Control de Rhipicephalus microplus (Acari: Ixodidae) mediante el uso del hongo entomopatógeno Metarhizium anisopliae (Hypocreales: Clavicipitaceae). Revista Mexicana de Ciencias Pecuarias 2 (2): 177-192.
Padgett KA, Casher LE, Stephens SL, Lane RS (2009) Effect of prescribed fire for tick control in California chaparral. Journal of Medical Entomology 46(5): 1138-45.
Parizi LF, Pohl PC, Masuda A, Silva Vaz Junior I (2009) New approaches toward anti-Rhipicephalus (Boophilus) microplus tick vaccine. Revista Brasileira de Parasitologia Veterinaria 18(1): 1-7.
Pathak D, Mathur VC, Latha BR, John L (2004) In vitro effect of indigenous plant extracts on ixodid ticks of small ruminants. Indian Journal of Animal Sciences 74: 616-617.
Perez-Cogollo LC, Rodriguez-Vivas RI, Ramirez-Cruz GT, Miller RJ (2010) First report of the cattle tick Rhipicephalus microplus resistant to ivermectin in Mexico. Veterinary Parasitology 168: 165-169.
Redondo M, Fragoso H, Montero C, Lona J, Medellin JA, Fria R, Hernandez V, Franco R, Machado H, Rodriguez M, de la Fuente J (2004) Integrated control of acaricide-resistant Boophilus microplus populations on grazing cattle in Mexico using vaccination with Gavac and amidine treatments. Experimental and Applied Acarology 23: 841-849.
Rodriguez-Valle M, Méndez L, Valdez M, Redondo M, Montero-Espinosa CM, Vargas M, Cruz RL, Barrios HP, Seoane G, Ramirez ES, Boue O, Vigil JL, Machado H, Nordelo CB, Piñeiro MJ (2004) Integrated control of Boophilus microplus ticks in Cuba based on vaccination with the anti-tick vaccine Gavac. Experimental and Applied Acarology 34: 375-382.
Rodríguez-Vivas RI, Alonso-Díaz MA, Rodríguez-Arévalo F, Fragoso-Sánchez H, Santamaria VM, Rosario-Cruz R (2006a) Prevalence and potential risk factors for organophosphate and pyrethroid resistance in Boophilus microplus ticks on cattle ranches from the State of Yucatan, Mexico. Veterinary Parasitology 336: 335-342.
Rodriguez-Vivas RI, Arieta-Román JR, Perez-Cogollo LC, Rosado-Aguilar JA, Ramírez-Cruz GT, Basto-Estrella G (2010) Uso de lactonas macrocíclicas para el control de la garrapata Rhipicephalus (Boophilus) microplus en el ganado bovino. Archivos de Medicina Veterinaria 42 (3): 115-123.
Rodríguez-Vivas RI, Ojeda-Chi MM, Pérez-Cogollo LC, Rosado-Aguilar JA (2011) Epidemiología y control de Rhipicephalus (Boophilus) microplus en México. Capítulo 33. En: Epidemiología de enfermedades parasitarias en animales domésticos. Editores: Quiroz RH, Figueroa CJA, López AME. AMPAVE. pp: 477-504.
Rodríguez-Vivas RI, Quiñones AF, Fragoso SH (2005) Epidemiología y control de la garrapata Boophilus en México. En: Enfermedades de importancia económica en producción animal. Rodríguez-Vivas, R.I. Editor. México D.F. McGraw-Hill-UADY. pp: 571-592.
Rodríguez-Vivas RI, Rivas AL, Chowell G, Fragoso SH, Rosario CR, García Z, Smith SD, Williams JJJ, Schwager SJ (2007) Spatial distribution of acaricide profiles Boophilus microplus (strains susceptible or resistant to acaricides) in south eastern Mexico. Veterinary Parasitology 146: 158-169.
Rodríguez-Vivas RI, Rodríguez-Arevalo F, Alonso-Díaz MA, Fragoso-Sánchez H, Santamaría VM, Rosario-Cruz R (2006b) Amitraz resistance in Boophilus microplus ticks in cattle farms from the state of Yucatan, Mexico: Potential risk factors. Preventive Veterinary Medicine 75: 280-286.
Rosado-Aguilar JA, Rodriguez-Vivas RI, Garcia-Vazquez Z, Fragoso-Sanchez H, Ortiz-Najera A, Rosario-Cruz R (2008) Development of amitraz resistance in field populations of Boophilus microplus (Acari: Ixodidae) undergoing typical amitraz exposure in the Mexican tropics. Veterinary Parasitology 152(3-4): 349-353.
Rosado-Aguilar JA, Aguilar-Caballero A, Rodriguez-Vivas RI, Borges-Argaez R, Garcia-Vazquez Z, Mendez-Gonzalez M (2010a) Acaricidal activity of extracts from Petiveria alliacea (Phytolaccaceae) against the cattle tick, Rhipicephalus (Boophilus) microplus (Acari: ixodidae). Veterinary Parasitology 168 (3-4): 299-303.
Rosado-Aguilar JA, Aguilar-Caballero AJ, Rodriguez-Vivas RI, Borges-Argaez R, García-Vázquez Z, Méndez-González M (2010b) Screening of the acaricidal efficacy of phytochemical extracts on the cattle tick Rhipicephalus (Boophilus) microplus (acari: ixodidae) by larval immersion test. Tropical and Subtropical Agroecosystem 12(1): 417-422.
Rosado-Aguilar JA, Rodriguez-Vivas RI, Garcia-Vazquez Z, Fragoso-Sanchez H, Ortiz-Najera A, Rosario-Cruz R (2008) Development of amitraz resistance in field populations of Boophilus microplus (Acari: Ixodidae) undergoing typical amitraz exposure in the Mexican tropics. Veterinary Parasitology 152 (3-4): 349-353.
Sardá-Ribeiro VLC, Tiogo E, Bordignon SAL, Goncalves K, Poser GV (2007) Acaricidal propieties of extraes from the aerial parts of Hypericum polyanthemun on the cattle tick Boophilus microplus. Veterinary Parasitology 147: 199-203.
Solari MA, Cuore U, Sanchis J, Gayo V, Trelles A, Bermudez F, Rizzo E (2007) Seminario Regional, FAO: Aplicación del control integrado de parásitos (CIP) a la garrapata Boophilus microplus en Uruguay. Aplicación del control integrado de parásitos (CIP) en un establecimiento comercial. Montevideo, Uruguay, pp: 9-25.
Taylor M, Coop MA, Wall RL (2007) Veterinary Parasitology. Third edition. Blackwell Publishing. London, UK. 697 p.
Utech KB, Wharton RH, Kerr JD (1978) Resistance to Boophilus microplus (Canestrini) in different breeds of cattle. Australian Journal of Veteterinary Research 21: 163-81.
Verrisimo JC, Machado SG (1995) Fase de vida livre do ciclo evolutivo do carrapato Boophilus microplus. Zootecnia 33: 41-53.
Wilkinson PR (1970) Factors affecting the distribution and abundance of the cattle tick in Australia: Observations and hypotheses. France Acarology 12(3): 492-508.
Willadsen P (1997) Novel vaccines for ectoparasites. Veterinary Parasitology 71(2-3): 209-222.
Willadsen P (2006). Tick control: Thoughts on a research agenda. Veterinary Parasitology 138: 161-168.
Wilson LJ, Sutherst RW, Kerr JD (1989) Trapping of larvae of the cattle tick, Boophilus microplus, by Stylosanthes scabra under field grazing conditions. Australian Journal of Agricultural Research 40: 1301-1308.