Artículo científico
ÁCIDOS FENÓLICOS CON ACTIVIDAD ANTIOXIDANTE EN SALVADO DE MAÍZ Y SALVADO DE TRIGO
Phenolic acids with antioxidant activity in maize bran and wheat bran
Vania Urías-Orona1, José Basilio Heredia2, Dolores Muy-Rangel2, Guillermo Niño-Medina3*
1 Universidad Autónoma de Nuevo León, Facultad de Salud Pública y Nutrición, Av. Dr. Eduardo Aguirre Pequeño y Yuriria, CP. 64460, Col. Mitras Centro Monterrey, Nuevo León, México.
2 Centro de Investigación en Alimentación y Desarrollo, A.C., Unidad Culiacán. Carretera a Culiacán-EI Dorado, km. 5.5, CP. 80129, Culiacán, Sinaloa, México.
3* Universidad Autónoma de Nuevo León, Facultad de Agronomía,Francisco Villa s/n, CP. 66050, Col. Ex-Hacienda El Canadá, Escobedo, Nuevo León, México.
*Autor de correspondencia: guillermo.ninomd@uanl.edu.mx, nino.medina.g@gmail.com
Artículo recibido el 17 de octubre de 2014
Aceptado el 14 de junio de 2015
RESUMEN
Ácidos fenólicos solubles y ligados, fueron obtenidos de salvado de maíz y trigo, en los que se determinaron los niveles de fenoles totales (Folin-Ciocalteu), ácidos fenólicos (HPLC), actividad antioxidante (DPPH, ORAC) y presencia de ácidos diferúlicos (espectros UV). Las concentraciones de fenoles totales, ácido ferúlico y ácido cumárico fueron de 1 637 a 9 718 µg EAF g-1, de 12 a 4 527 µg g-1 y de 7 a 664 µg g-1, mientras que la actividad antioxidante fue de 9.52 a 64.14 % de inhibición de DPPH y de 11.46 a 67.09 µmol ET g-1 en ORAC. Se identificó la presencia de los ácidos diferúlicos 8-8’, 8-5’, 5-5’ y 8-0-4’ en las fracciones ligadas. Todas las fracciones presentaron niveles importantes de fenoles totales, ácidos fenólicos y actividad antioxidante, siendo la fracción ligada de salvado de maíz la que presentó las mayores concentraciones.
Palabras clave: Ácidos fenólicos, DPPH, fenoles totales, ORAC, Salvado maíz, salvado trigo
ABSTRACT
Soluble and bound phenolic acids were obtained from maize and wheat bran and the level of total phenols were determined (Folin-Ciocalteu), phenolic acids (HPLC), antioxidant activity (DPPH, ORAC) and the presence of diferulic acids (UV spectra). The concentrations of total phenols, ferulic acid, and coumaric acid ranged from 1 637 to 9 718 µg EAF g-1, from 12 to 4 527 µg g-1 and from 7 to 664 µg g-1, while the antioxidant activity µmol ET g-1 acids 8-8’, 8-5’, 5-5’ and 8-0-4’ was identified in the bound fractions. All fractions presented significant levels of total phenols, phenolic acids and antioxidant activity, the bound fraction of maize bran being the one that presented the highest concentrations.
Key words: Phenolic acids, DPPH, Total phenols, ORAC, Maize bran, Wheat bran
INTRODUCCIÓN
Los ácidos fenólicos son metabolitos secundarios ampliamente distribuidos en el reino vegetal, se clasifican en ácidos hidroxibenzoicos y ácidos hidroxicinámicos (Robbins 2003, Stalikas 2007). Una de las principales propiedades biológicas de estos compuestos es su alta actividad antioxidante, que se debe a su estructura química, que contiene un núcleo fenólico y una cadena lateral insaturada que les permite formar un radical fenoxilo estabilizado por resonancia, el cual tiene actividad como agente secuestrador de radicales libres (Srinivasan et al. 2007, Adelakun et al. 2012). Por lo que los ácidos fenólicos están relacionados con la protección del ADN y los lípidos de la membrana celular contra las especies reactivas de oxígeno, sugiriéndose su uso como agentes preventivos de enfermedades ligadas al estrés oxidativo (Kanski et al. 2002, Zhao y Moghadashian 2008). Los compuestos fenóli-cos más abundantes en los cereales son los ácidos hidroxicinámicos, siendo el ácido ferúlico el principal, seguido por los ácidos diferúlicos y cumárico, también se ha reportado que 90 % del ácido ferúlico presente en los cereales se encuentra unido a arabi-noxilanos por medio de enlaces éster y el resto en forma libre (Scalbert y Williamson 2000, Nackz y Sha h id i 2006). El 98 % del total de ácido ferúlico se encuentra distribuido en los tejidos externos de los cereales, siendo la capa aleurona y el pericarpio externo los principales (Manach et al. 2004, Vitaglione et al. 2008). En México, se producen entre 20 000 y 70 000 toneladas de salvado de maíz y trigo por mes, las cuales provienen de la producción de harina de maíz nixtamalizado y de harina de trigo respectivamente, las cuales se comercializan a bajo costo para la alimentación animal (INEGI, 2014). Por lo anterior, el objetivo del presente estudio fue explorar el potencial del salvado de maíz y trigo, como fuentes de ácidos fenólicos con actividad antioxidante para obtener productos funcionales y nutracéuticos de alto valor comercial.
MATERIALES Y MÉTODOS
Preparación de la muestra
Se usaron muestras de salvado de maíz y trigo donadas por AGROINSA Monterrey. El material se molió y tamizó a un tamaño de partícula, menor de 0.5 mm (malla 35). Para luego desgrasar con acetona (1:25 p/v) durante 4 h en agitación orbital a 200 rpm, filtrar y secar a 40 °C durante 24 h.
Extracción de ácidos fenólicos libres
Se suspendieron 100 mg de salvado en 5 mL de metanol al 80 % (pH 2.5), la muestra se purgó con flujo de argón por 30 s y se agitó orbitalmente a 200 rpm por 4 h. Para luego centrifugar a 4 650 g y recuperar el sobrenadante, para almacenarlo hasta su análisis a -20°C.
Extracción de ácidos fenólicos ligados
Se suspendieron 100 mg de muestra en 5 mL de NaOH 2 mol L-1, la muestra se purgó con flujo de argón por 30 s y agitó orbitalmente a 200 rpm durante 4 h. Para después ajustar el pH a 2.5 con HCI concentrado y centrifugar a 4 650 g, el sobrenadante se recuperó y los compuestos fenólicos se extrajeron con 5 mL de acetato de etilo en dos ocasiones. Los extractos de acetato de etilo se combinaron y evaporaron a 40 °C con flujo de argón. El extracto seco se almacenó a -20 °C y antes de su análisis se suspendió en 3 mL de metanol al 80 % (pH 2.5).
Fenoles totales y ácidos fenólicos
Para la determinación de fenoles totales se tomaron 15 µL de extracto, se agregaron 240 µL de agua destilada y 15 µL del reactivo Folin-Ciocalteu. Después de 5 min se agregaron 30 µL de Na2CO3 al 7 %, la solución se agitó durante 30 s, para luego llevar la reacción en oscuridad por 90 min, posteriormente se midió la absorbancia de las muestras a 750 nm. La concentración se obtuvo usando la ecuación de regresión lineal de la curva de calibración establecida con ácido ferúlico en concentraciones de 0 a 200 mg L-1, el resultado se expresó en micro-gramos equivalentes de ácido ferúlico por gramo de muestra (µgEAF g-1). La cuantificación de ácidos fenólicos se llevó a cabo en un HPLC Varian ProStar equipado con detector UV-Vis con arreglo de diodos ProStar 330 y bomba terciaria ProStar 230 (Wallnut Creek, CA, USA), de acuerdo con Whitaker y Stom-mel (2003), utilizando una columna analítica Phe-nomenex Luna C18 (4.6 x 250mm, 5µ) (Torrence, CA, USA) con un gradiente de fase móvil binaria compuesta por metanol y acido fosfórico al 0.01 % y un volumen de inyección de 20 µL de muestra. La concentración de las muestras se obtuvo usando la ecuación de regresión lineal de las curvas de calibración obtenidas con los ácidos ferúlico, cumárico, cafeico y sinápico (Sigma-Aldrich, St. Louis, MO, USA) en concentraciones de 0 a 200 mg L-1, el resultado se expresó en microgramos equivalentes de cada ácido fenólico por gramo de muestra (µg g-1). La identificación de los ácidos diferúlicos se llevó a cabo por medio de un barrido del espectro UV (200 a 400 nm) en los compuestos desconocidos de los cromatogramas y se compararon con los espectros UV de ácidos diferúlicos reportados por Waldron et al. (1996) y Dobberstein y Bunzel (2010).
Actividad Antioxidante
El ensayo de decoloración del radical DPPH (2,2-Difenil-l-picrilhidrazil), se realizó adicionando 280 µL de DPPH (60 µmol L-1 en metanol al 80 %) a 20 µL del extracto, la reacción se llevó a cabo durante 30 min en oscuridad y se midió la absorban-cia de las muestras a 515 nm, se utilizó metanol al 80 % para el ajuste a cero y como control para la medición de la absorbancia inicial. El resultado se reportó como porcentaje de inhibición del DPPH con la fórmula: %lnh=[(Ac/Am)/Ac]*100, donde: Ac=Absorbancia del control y Am=Absorbancia de la muestra. El ensayo ORAC (capacidad de absorción de radicales oxígeno) se llevó a cabo tomando 5 µL del extracto, al cual se le adicionaron 200 µL de fluoresceína (0.96 µmol L-1) y 75 µL de AAPH (2,2"-Azobis (2-metilpropionamidina) di-hidrocloruro) (95.8 µmol L-1). A partir de la adición del AAPH se midió la fluorescencia de las muestras durante 70 min a intervalos de 70 s entre lecturas a longitud de onda para excitación de 485 nm y para emisión de 580 nm. Como blanco se utilizo buffer de fosfatos 75 µmol L-1, pH 7.5, misma unidad utilizada para la curva de calibración estándar Trolox. Los cálculos de la concentración se realizaron con la ecuación de regresión lineal de la curva estándar de Trolox de 0 a 100 µmol L-1 y el área bajo la curva de la pérdida de fluorescencia, los resultados se reportaron como micromoles equivalentes de Trolox por gramo de muestra (µmol ET g-1).
Análisis estadístico
Todos los análisis se realizaron por triplicado. Para cada una de las variables se realizó un análisis de varianza y en caso de efectos significativos se determinaron las diferencias mediante la prueba de Tukey (p < 0.05), todos los datos se analizaron con el paquete estadístico Minitab versión 14.1.
RESULTADOS
Fenoles totales y ácidos fenólicos
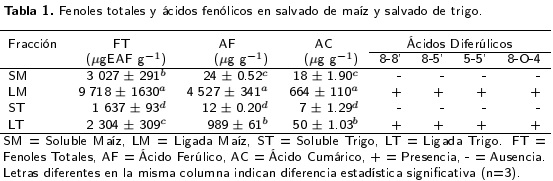
La concentración de fenoles totales (solubles + ligados) fue de 12 746 y 3 944 µgEAF g-1 para maíz y trigo, respectivamente. El análisis estadístico mostró diferencia significativa (p < 0.05) entre todas las fracciones, siendo la porción ligada de ácidos fenólicos de maíz la que presentó los niveles más altos de fenoles totales, ácido ferúlico y ácido cumárico, mientras que la de menor concentración fue la soluble de trigo (Tabla 1). El contenido de ácido ferúlico total (solubles + ligados) fue de 4 551 µg g-1 para maíz y 1 001 µg g-1 para trigo, mientras que en ácido cumárico total (solubles + ligados) los niveles fueron de 682 µg g-1 en maíz y 57 µg g-1 en trigo. Los ácidos diferúlicos 8-8", 8-5’, 5-5’ y 8-0-4’ (Figura 1) fueron identificados en base al espectro UV y se encontraron solo en las fracciones ligadas.
Actividad antioxidante
La fracción ligada de ácidos fenólicos de maíz presentó la mayor actividad antioxidante tanto en el ensayo DPPH como en el ensayo ORAC, los valores de la actividad antioxidante total (solubles + ligados) en el ensayo DPPH fueron de 86.09 y 31.71 % para maíz y trigo, respectivamente; mientras que para el ensayo ORAC la sumatoria total fue de 105.56 µmolET g-1 para maíz y 26.12 µmolET g-1 para trigo (Tabla 2). Los valores para la actividad antioxidante total (solubles + ligados) de las fracciones de maíz fue 2.5 y 4.0 veces mayor que las fracciones de trigo en los ensayos DPPH y ORAC.
DISCUSIÓN
Fenoles totales y ácidos fenólicos
Una concentración cinco veces mayor a la de nuestro estudio fue reportada por Inglett y Chen (2011) en fracciones ligadas y solubles de maíz, lo cual se atribuye al tamaño de partícula utilizado por estos autores (15-30 jm) lo que favoreció una mejor extracción, debido a una mayor interacción muestra solvente. Los resultados de fenoles totales en salvado de trigo fueron similares a lo reportado por Kim et al. (2006) quienes reportaron valores de 3 362 a 3 967 µgEAF g-1. El total de á ferúlico y ácido cumárico en salvado de maíz fue de 4 551 y 682 µg g-1. Estas centraciones son menores a los 30 000 µg g-1 de ácido ferúlico encontrados por Agger et al. (2010) y a los 27 000 µg g-1 de ácido ferúlico y 2 900 µg g-1 de ácido cumárico reportados por Zhao et al. (2005) utilizando tratamientos enzimáticos en el proceso de extracción. Además la concentración de ácidos fenólicos en salvado de maíz del presente estudio fue similar a lo encontrado por Chiremba et al. (2012), con rangos de 2 500 a 4 700 µg g-1 de ácido ferúlico y de 171 a 547 µg g-1 de ácido cumárico con extracción asistida por microondas en cortos periodos tiempo. Por otra parte, las concentraciones de ácido ferúlico y cumárico en salvado de trigo fueron de 1 001 y 57 µg g-1, respectivamente; estos resultados se encontraron dentro del rango de 891 a 1 253 µg g-1 de ácido ferúlico y de 28 a 75 µg g-1 de ácido cumárico obtenidos por Jonnala et al. (2010). El ácido ferúlico es el ácido fenólico mayoritario en todas las fracciones, seguido del ácido cumárico, mientras que los ácidos sinápico y cafeico se encontraron en cantidades trazas o no fueron detectados en algunas muestras. En todos los casos, el total de ácidos fenólicos cuantificados por HPLC (ferúlico + cumárico) fue menor al contenido de fenoles totales obtenidos por el método Folin-Ciocalteu, que es semejante a lo reportado por Verma et al. (2009). Este comportamiento se debe a la degradación oxidativa que sufren los ácidos hidroxicinámicos bajo condiciones alcalinas, lo que lleva a la producción de derivados benzalde-hído como vainillina y 4-hidroxibenzaldehído a partir de ácido ferúlico y ácido cumárico respectivamente (Dobberstein y Bunzel 2010), los cuales reaccionan en el ensayo Folin-Ciocalteu pero no son detectables en el ensayo HPLC. Por otro lado, en las fracciones ligadas la presencia de ácidos diferúlicos afecta la cuantificación de fenoles totales, ya que contribuyen a una mayor reactividad del reactivo Folin-Ciocalteu y la correspondiente mayor cuantificación. Los ácidos diferúlicos 8-8’, 8-5’, 5-5’ y 8-0-4’ (Figura 1) fueron identificados como positivos en las fracciones ligadas de maíz y trigo, debido a que los espectros UV obtenidos en nuestro estudio coinciden con los reportados previamente por Waldron et al. (1996) y Dobberstein y Bunzel (2010). El hecho de encontrar los niveles más altos de ácido ferúlico e identificar los ácidos diferúlicos solo en las fracciones ligadas, se debe a que fueron sometidas a condiciones de alcalinidad y bajo estas condiciones se lleva a cabo la ruptura de los enlaces éster por los que el ácido ferúlico realiza los entrecruzamientos de arabinoxilanos-lignina-proteínas en la matriz estructural de la pared celular de los cereales (Buanafina 2009, Bunzel 2010).
Actividad antioxidante
La cantidad de fenoles totales se relaciona con los resultados observados en la determinación de actividad antioxidante mediante el ensayo ORAC, mientras que el ensayo DPPH se relaciona mejor con el contenido de ácido ferúlico. Este comportamiento se explica a causa del mecanismo de reacción específica que se lleva a cabo en cada ensayo de actividad antioxidante. El ensayo ORAC utiliza un mecanismo en el cual los compuestos presentes en el extracto hacen transferencia de átomos de hidrogeno, por lo que cualquier compuesto que tenga disponibles radicales hidroxilos puede producir la inhibición de los radicales peroxilo; por otro lado, cuando el ensayo DPPH se efectúa sobre extractos fenólicos, se realiza la transferencia de electrones por medio de los aniones fenóxidos (Foti et al. 2004, Huang et al. 2005). La inhibición total de las fracciones de maíz (ligados + solubles) en el ensayo DPPH fue de 85.28 %, lo cual es superior a lo reportado por López-Martínez et al. (2009), quienes obtuvieron una inhibición del 45 % analizando fracciones solubles y ligadas de maíz blanco. En cuanto al ensayo ORAC, la sumatoria de las fracciones obtenidas de maíz alcanzó 105 µmolET g-1, lo cual es superior a lo reportado por Del Pozo-lnsfran et al. (2007) quienes encontraron 17.4 µmolET g-1 en fracciones solubles de maíz blanco. La actividad antioxidante total (ligados + solubles) para salvado de trigo en el ensayo de DPPH fue de 31.71 % de inhibición, lo que se ubicó dentro de lo reportado por Verma et al. (2009) con inhibición de 25 a 32 %. Por otro lado, estos resultados son superiores a lo encontrado por Mpofu et al. (2006) quienes observaron de 13 a 15 % de inhibición del radical DPPH en fracciones solubles obtenidas de grano entero de trigo. En el ensayo ORAC, el salvado de trigo alcanzó 26.12 µmolET g-1 totales (ligados + solubles) lo cual es inferior a las concentraciones reportadas por Zhou et al. (2004) de 107 µmolET g-1 en salvado de trigo. A pesar de que el ácido ferúlico es el principal ácido fenólico en el salvado de maíz y trigo, se ha reportado que algunos de los ácidos diferúlicos presentan mayor actividad antioxidante. Al respecto García-Conesa et al. (1999) reportó que el ácido diferúlico 8-8’ tiene mayor actividad antioxidante que el ácido ferúlico mediante los ensayos ABTS e inhibición de la peroxidación lipídica, explican que este aumento se debe a una mejor estabilización en la estructura y a la presencia de dos grupos hidroxilos unidos a cada anillo fenólico. Por otro lado, Adelakun et al. (2012) reportaron una mayor actividad antioxidante del ácido diferúlico 8-5’ por medio del ensayo DPPH, atribuyen este aumento a que el número de grupos donadores de electrones y de grupos carboxílicos adyacentes con dobles enlaces insaturados carbono-carbono, proveen sitios adicionales para el ataque de radicales libres. Debido a esto, sería importante en estudios futuros establecer el aporte individual a la actividad antioxidante de cada uno de los ácidos diferúlicos presentes en el salvado de maíz y trigo.
CONCLUSIONES
Los resultados indican que el salvado de maíz y salvado de trigo son fuentes importantes de ácidos fenólicos con actividad antioxidante, siendo el ácido ferúlico el de mayor presencia. Se necesitan estudios sobre la viabilidad técnica-económica de los procesos de extracción y estudios de biodisponibilidad de estos compuestos para su posible utilización en la formulación de alimentos funcionales y/o productos nutracéuticos.
AGRADECIMIENTOS
Al Programa de Apoyo a la Investigación Científica y Tecnológica (PAICyT) 2010 Proyecto CN450-10 de la Universidad Autónoma de Nuevo León por el financiamiento otorgado. A la Dra. María Dolores Muy-Rangel y al Dr. Basilio Heredia por el apoyo brindado y sus observaciones al manuscrito.
LITERATURA CITADA
Adelakun OE, Kudanga T, Parker A, Green IR, Roes-Hill ML, Burton SGJ (2012) Laccase-catalyzed dimerization of ferulic acid amplifies antioxidant activity. Journal of Molecular Catalysis B: Enzymatic 74: 29-35.
Agger J, Vikso-Nielsen A, Meyer AS (2010) Enzimatic xylose release from pretreated corn bran arabinoxylan: differential effects of deacetylation and deferuloylation on insoluble and soluble substrate fractions. Journal of Agricultural and food Chemistry 58: 6141-6148.
Buanafina MMO (2009) Feruloylation in grasses: current and future perspectives. Molecular Plant 2: 861872.
Bunzel M. (2010) Chemistry and occurrence of hydroxycinnamate oligomers. Phytochemistry Reviews 9: 47-64.
Chiremba C, Rooney LW, Beta T (2012) Microwave-assisted extraction of bound phenolic acids in bran and flour fractions from sorghum and maize cultivars. Journal of Agricultural and Food Chemistry 60: 4735-4742.
Del Pozo-lnsfran D, Serna-Saldivar SO, Brenes CH, Talcott ST (2007) Polyphenolics and antioxidant capacity of white and blue corns processed into tortillas and chips. Cereal Chemistry 84: 162-168.
Dobberstein D, Bunzel M (2010) Separation and detection of cell wall-bound ferulic acid dehydrodimers and dehydrotrimers in cereals and other plant materials by reversed phase high-performance liquid chromatography with ultraviolet detection. Journal of Agricultural and Food Chemistry 58: 8927-8935.
Foti CM, Daquino C, Geraci C (2004) Electron-transfer reaction of cinnamic acids and their methyl esters with the DPPH radical in alcoholic solutions. Journal of Organic Chemistry 69: 2309-2314.
García-Conesa MT, Wilson PD, Plumb GW, Ralph J, Williamson G (1999) Antioxidant properties of 4,4’-dihydroxy-3-3’-dymethoxy-β-β-bicinnamic acid (8-8-diferulic acid, non-cyclic form). Journal of the Science of Food and Agriculture 79: 379-384.
Huang D, Ou B, Prior RL(2005) The chemistry behind antioxidant activity. Journal of Agricultural and Food Chemistry 53: 1841-1856.
Inglett GE, Chen D (2011) Antioxidant activity and phenolic content of air-classified corn bran. Cereal Chemistry 88: 36-40.
Instituto Nacional de Estadística y Geografía (INEGI) (2014) http://www.inegi.org.mx/sistemas/bie/default.aspx?idserPadre=10400100015400100020002000300010D10400100015400100020002000300010. Fecha de consulta 31 mayo 2014.
Jonnala RS, Irmak S, MacRitchie F, Bean SR (2010) Phenolics in the bran of waxy wheat and triticale lines. Journal of Cereal Science 52: 509-515.
Kanski J, Aksenova M, Stoyanova A, Butterfields DA (2002) Ferulic acid antioxidant protection against hydroxyl and peroxyl radical oxidation in synaptosomal and neuronal cell culture systems in vitro: structure-activity studies. Journal of Nutritional Bichemistry 13: 273-281.
Kim KH, Tsao R, Yang R, Cui SW (2006) Phenolic acid profile and antioxidant activities of wheat bran extracts and the effect of hydrolysis conditions. Food Chemistry 95: 466-473.
Lopez-Martinez LX, Oliart-Ros RM, Valerio-Alfaro G, Lee CH, Parkin KL, García HS (2009) Antioxidant activity, phenolic compounds and anthocyanins content of eighteen strains of Mexican maize. LWT-Food Science and Technology 42: 1187-1192.
Manach C, Scalbert A, Morand C, Rémésy C, Jiménez L (2004) Polyphenols: food sources and bioavailability. American Journal of Clinical Nutrition 79: 727-747.
Mpofu A, Sapirstein HD, Beta T (2006) Genotype and environmental variation in phenolic content, phenolic acid composition and antioxidant activity of hard spring wheat. Journal of Agricultural and Food Chemistry 54: 1265-1270.
Nackz M, Shahidi F (2006) Phenolics in cereals, fruits and vegetables: occurrence, extraction and analysis. Journal of Pharmaceutical and Biomedical Analysis 41: 1523-1542.
Robbins RB (2003) Phenolic acids in foods: an overview of analytical methodology. Journal of Agricultural and Food Chemistry 51: 2866-2887.
Scalbert A, Williamson G (2000) Dietary intake and bioavailability of polyphenols. Journal of Nutrition 130: 2073S-2085S.
Srinivasan M, Sudheer AR, Menon VP (2007) Ferulic acid: therapeutic potential through its antioxidant property. Journal of Clinical Biochemistry and Nutrition 40: 92-100.
Stalikas CD (2007) Extraction, separation and detection methods for phenolic acids and flavonoids. Journal of Separation Science 30: 3268-3295.
Verma B, Hucl P, Chibbar RN (2009) Phenolic acid composition and antioxidant capacity of acid and alkali hydrolysed wheat bran fractions. Food Chemistry 116: 947-954.
Vitaglione P, Napolitano A, Fogliano V (2008) Cereal dietary fibre: a natural functional ingredient to deliver phenolic compounds into the gut. Trends in Food Science and Technology 19: 451-463.
Waldron KW, Parr AJ, Ng A, Ralph J (1996) Cell wall esterified phenolic dimers: identification and quantification by reverse phase high performance liquid chromatography and diode array detection. Phytochemistry Analysis 7: 305-312.
Whitaker BD, Stommel JR (2003) Distribution of hydroxycinnamic acid conjugates in fruit of commercial eggplant (Solarium melongena L). Journal of Agricultural and Food Chemistry 51: 3448-3454.
Zhao Z, Moghadasian MH (2008) Chemistry, natural sources, dietary intake and pharmacokinetic properties of ferulic acid: a review. Food Chemistry 109: 691-702.
Zhao Z, Egachira Y, Sanada H (2005) Phenolic antioxidants richly contained in corn bran are slightly bioavailable in rats. Journal of Agricultural and Food Chemistry 53: 5030-5035.
Zhou K, Laux JJ, Yu L (2004) Comparison of Swiss red wheat grain and fractions for their antioxidant properties. Journal of Agricultural and Food Chemistry 52: 1118-1123.