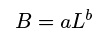
Artículo científico
Estructura de los ensamblajes de peces arrecifales de tres áreas marinas protegidas del pacífico mexicano
Reef fish assemblage structure of three marine protected areas from the mexican Pacific
Cristian Moisés Galván-Villa
Laboratorio de Ecosistemas Marinos y Acuicultura. Departamento de Ecología. CUCBA. Universidad de Guadalajara. Km. 15.5, carretera a Nogales, Las Agujas, Nextipac, C.P.45110, Zapopan, Jalisco, México.
gvc07765@cucba.udg.mx
Recibido el 6 de febrero de 2014
Aceptado el 3 de septiembre de 2014
RESUMEN.
En este trabajo se describe la estructura de los ensamblajes de peces de arrecife de tres Áreas Marinas Protegidas de México (Isla Isabel, Islas Marietas e islas de Bahía Chamela). Se realizaron conteos visuales para registrar las especies de peces, su abundancia y talla estimada. Además, se tomaron video-transectos para estimar la cobertura de algunos elementos del hábitat bentónico. Se registraron 114 especies, 84 géneros y 47 familias. En Isla Isabel la especie más abundante fue Thalassoma lucasanum y con mayor biomasa fue Prionurus punctatus en Islas Marietas y Bahía Chamela la más abundante fue Halichoeres dispilus y con mayor biomasa Epinephelus labriformis. Los análisis de redundancia canónica indicaron que la presencia de peces se correlaciona con la cobertura de arena, esponjas y corales blandos. Isla Isabel obtuvo la mayor riqueza de especies y biomasa, pero las islas Marietas y de Bahía Chamela tuvieron la mayor abundancia. La estimación de la biomasa permitió identificar otras especies importantes en la estructura del ensamblaje de peces para las islas del Pacífico mexicano. Aparentemente el aislamiento de la Isla Isabel es un factor que beneficia su estado de preservación, a pesar de no tener protección oficial de la zona marina adyacente.
Palabras clave: Diversidad, biomasa, abundancia, riqueza, islas, correlación.
ABSTRACT.
This study describes the structure of the reef fish assemblages of three marine protected areas (Isla Isabel, Islas Marietas, and islands of Bahía Chamela) from México. Visual transects were made for recorder the fish species, abundance, and size. Video-transects were also taken to estímate the cover of some elements of benthonic habitat. A total of 114 species, 84 genera, and 47 families were registered. In Isla Isabel the most abundant species was Thalassoma lucasanum and the highest biomass was Prionurus punctatus; in Islas Marietas and Bahía Chamela the most abundant species was Halichoeres dispilus and the species with highest biomass was Epinephelus labriformis. Canonical redundancy analysis indicated that fish presence was highly correlated with sand, sponges, and soft coráis covers. Isla Isabel got the highest species richness and biomass, but Marietas and Bahía Chamela islands had higher abundance. The estimation of biomass allowed identifying other important species in fish assemblage structure from the Mexican Pacific islands. Apparently, the higher isolation of Isla Isabel is a factor that support its preservation status even though it does not have official protection of the adjacent marine zone.
Key words: Diversity, biomass, abundance, richness, islands, correlation.
INTRODUCCIÓN
Las islas funcionan como reservorios para muchas de las especies amenazadas en el mundo y son causa de atención especial en la toma de decisiones de conservación (Whittaker y Fernández-Palacios 2007). Un patrón común es que los sistemas insulares naturales poseen menos riqueza de especies que los ambientes continentales (Brown y Lomolino 1998). Sin embargo, las islas pueden albergar especies de las zonas continentales, otras tantas endémicas de la región o de las propias islas, e incluso especies que ocurren en otras zonas del mismo océano (Leis 1984).
Los peces son parte importante de la riqueza biótica de los sistemas arrecifales insulares de todo el mundo (Bellwood y Wainwright 2002). También, son uno de los recursos marinos más abundantes que proporcionan alimento y otros beneficios económicos a las poblaciones humanas (Sale 2002).
Los estudios ecológicos sobre la estructura y función de los ensamblajes de peces resultan de gran importancia para ser considerados en el desarrollo de políticas de manejo y uso adecuado de los recursos marinos, porque permiten seleccionar las áreas más adecuadas para la conservación de la biodiversidad y el uso razonable de los recursos pesqueros (Gladstone 2007). A lo largo de todo el Pacífico mexicano se han realizado diversos estudios sobre la estructura de los ensamblajes de peces y las posibles variables que determinan su distribución y abundancia (Aburto-Oropeza y Balart 2001, Rodríguez-Romero et al. 2005, Álvarez-Filip et al. 2006, Ramírez-Gutiérrez et al. 2007, Villegas-Sánchez et al. 2009, López-Pérez et al. 2012); de estas se puede encontrar una serie de investigaciones encaminadas a describir aspectos taxonómicos y biogeográficos de peces en las islas concentradas principalmente en el Golfo de California (Del Moral-Flores et al. 2013). En este trabajo se describe la estructura de los ensamblajes de peces arrecifales de tres sistemas insulares decretados como Áreas Marinas Protegidas (AMPs); así como la importancia de las especies para cada una de las AMPs mediante el uso de varios índices ecológicos basados en la abundancia de las especies y en la biomasa estimada; y la relación de las principales especies con algunos elementos estructurales del hábitat bentónico y la complejidad topográfica.
MATERIALES Y MÉTODOS
Trabajo en campo
Entre 2004 y 2009 se visitaron tres AMPs ubicadas en el Pacífico mexicano que incluyen cincoislas: Parque Nacional Isla Isabel (21o 50' 52" N - 105o 53' 00" O), Parque Nacional Islas Marietas: Redonda y Larga (20o 42' 52" N - 105o 34' 05" O) y el Santuario Islas de Bahía Chamela: Cocinas y Cocinas y Pajarera (19o 32' 45" N - 105o 06' 37" O). En cada isla se eligieron cuatro sitios de muestreo, dos en la parte protegida y otros dos en la parte expuesta (Figura 1). Los sitios fueron elegidos por presentar características de arrecifes rocosos con presencia de colonias de coral. La composición, abundancia y talla de los peces, se obtuvo a partir de transectos visuales en banda (50 x 5 m), realizados mediante buceo autónomo por un mismo observador (English et al. 1997). La densidad de organismos se obtuvo dividiendo la abundancia de cada especie por transecto entre la superficie estimada de muestreo (250 m2). Los muéstreos se realizaron entre las 10:00 y 17:00 h durante dos estaciones (cálida-fría) en cada AMP. Se realizaron un total de 120 transectos (24 por isla y seis réplicas por cada sitio). La longitud total de los peces observados se estimó utilizando una regla de PVC marcada con segmentos de 10 cm cada uno. Con este dato se estimó la biomasa en gramos (B) para cada especie según la ecuación:
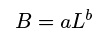
donde L es la talla promedio ponderada (cm), a y b son las constantes de la relación peso-talla de cada especie (Marks y Klomp 2003), estas fueron obtenidas de la base de datos de FishBase (Froese y Pauly 2014). El valor de la talla promedio ponderada o media armónica (L) fue estimado con:
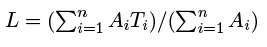
donde Ai es la densidad (Ind m2) de peces por cada intervalo de clase (cada 5 cm para todas las especies) y Ti es la talla promedio de cada intervalo de clase por especie. Para expresar la biomasa por especie en g m2, se multiplicó la biomasa por individuo en gramos por la abundancia total de individuos y después se dividió entre el área muestreada en cada transecto (250 m2).
Análisis de datos
Todos los análisis se realizaron a nivel de AMP debido a que no se encontraron diferencias significativas entre las islas que conforman cada una de ellas. La riqueza total de cada AMP se estimó mediante la riqueza de especies (Chao 1, Jackknife 1 y Jackknife 2) y se estimaron los indicadores singletons (especies con un individuo) y doubletons (especies con dos individuos) para determinar la rareza de especies. El esfuerzo de muestreo fue corroborado con curvas acumuladas de especies utilizando los valores obtenidos por los números de Hill: NI para especies abundantes (eH), donde e es la base del logaritmo natural y H es el índice de diversidad de Shannon; y N2 para especies muy abundantes (1/A), donde A es el índice de diversidad de Simpson (Hill 1973). Todas las curvas de acumulación de especies se realizaron con el programa EstimateS v8 (Colwell 2006).
Similitud entre AMPs
Para detectar patrones de similitud entre las tres AMPs se realizó un análisis de escalonamiento multidimensional no métrico (MDS), basado en una matriz de similitud con distancias euclidianas. Los datos fueron transformados (X1/4) y estandarizados a valores Z. Por otro lado, debido a la disparidad en el número de transectos las diferencias se probaron con un análisis de similitud no paramétrico (ANOSIM) de una vía (Clarke 1993). Se realizó un análisis de similitud de porcentajes (SIMPER) para identificar las especies discriminantes y su porcentaje de contribución para cada AMP (Clarke y Warwick 2001). Todos los análisis se realizaron con PRIMER v6 (Clarke y Gorley 2006).
Heterogeneidad del ambiente y su relación con el ensamblaje de peces
La heterogeneidad del ambiente se evaluó mediante estimaciones de la cobertura del fondo y la complejidad topográfica. Se analizaron dos video-transectos por cada sitio, los cuales se filmaron sobre una línea de 50 m de longitud a una profundidad de 40 cm, esto proporciona una imagen equivalente a una superficie de 0.4 m2, que permite distinguir los diferentes elementos estructurales del fondo. La revisión de los video-transectos se realizó con una serie de 13 puntos distribuidos sistemáticamente sobre un monitor y 40 pausas en cada video-transecto (Arias-González et al. 2008). Se definieron seis elementos del fondo: roca, arena, algas, esponjas, corales pétreos y corales blandos (gorgonáceos). La cobertura promedio (C) de cada elemento del fondo se estimó según:
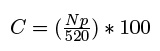
donde Np es el número de puntos observados por elemento en las 40 imágenes de cada video-transecto (WWF 2006). La complejidad topográfica (CT) se determinó con el método de cadena, el cual consiste en tomar una medición siguiendo el relieve del fondo con una cadena de 10 m de largo y compararla con una línea recta de referencia (Risk 1972):
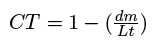
donde dm es la distancia de la línea de referencia desde el inicio hasta el punto final de la cadena y Lt es la longitud de la cadena. El valor del índice para cada AMP se obtuvo de la media de los valores de todas las muestras que corresponden al mismo número de videotransectos (Arias-González et al. 2008).
La correlación entre la abundancia y biomasa de los peces con los elementos estructurales del fondo se evaluó mediante un análisis de redundancia canónica (RDA) con el programa CANOCO v4.5 (ter Braak y Smilauer 2002). Se utilizó este método multivariado siguiendo el criterio de longitud del gradiente, con un modelo de respuesta de las especies al ambiente de tipo lineal. Cada RDA se realizó usando sólo las especies con mayor contribución a la abundancia y biomasa de cada AMP, determinadas previamente por los análisis SIMPER. Los valores de abundancia y biomasa fueron transformados mediante distancias de Hellinger (Rao 1995) y la significancia estadística fue probada mediante permutaciones Monte Cario (n = 9 999). La significancia estadística de las variables ambientales entre AMPs se probó mediante un análisis de varianza de una vía (ANOVA) con el programa Statgraphics vl5; previamente se comprobó la normalidad y homocedasticidad de los datos mediante una prueba de Levene.
RESULTADOS
Se registraron un total de 114 especies, 84 géneros y 47 familias (Tabla 1). La asíntota en las curvas de acumulación de especies indican que el esfuerzo de muestreo realizado fue representativo en cada AMP (Figura 2). Con el estimador Jackknife 2 se registró en Isla Isabel 71 % de la riqueza específica máxima esperada (120 spp.); para las Islas Marietas 67 % (114 spp.) y Bahía Chamela 81 % (99 spp.). Además, la rareza de especies determinada por los singletons y doubletons estuvo bien representada en las tres AMPs, manteniendo valores estables en las muestras. De manera general los singletons representaron 14 % (16 spp.) y los doubletons tan solo 5 % (6 spp.) del total de las especies registradas.
Para las tres AMPs las familias con el mayor número de especies fueron Labridae (10 spp.), Pomacentridae (8), Serranidae (7), Lutjanidae (6), Haemulidae (6) y Scaridae (5). Las especies más abundantes (> 1 000 organismos) fueron Chromis atrilobata (31.18 %), Apogon pacificus (16.09 %), Halichoeres dispilus (11.53 %), Thalassoma lucasanum (7.16 %), Haemulon maculicauda (4.48 %), Stegastes flavilatus (2.89 %), Prionurus punctatus (2.82 %) y Stegastes acapulcoensis (2.71 %). Para Isla Isabel se estimó una biomasa de 27.43 kg m-2, para las Islas Marietas de 8.03 Kg m-2 para las islas de Bahía Chamela de 15.23 kg m-2. Las especies con mayor biomasa fueron Caranx sexfasciatus (29.74 %), P. punctatus (16.08 %), H. maculicauda (12.13 %), Caranx caballus (3.84 %), Microspathodon dorsalis (3.26 %), Haemulon flaviguttatum (2.70 %) y Epinephelus labriformis (2.69 %); y en conjunto estas especies representaron 70 % de la biomasa total estimada en todo el estudio (N = 50.7 kg m-2) (Tabla 1).
Similitud entre AMPs
La composición y abundancia no presentó diferencias entre las tres AMPs, encontrando una alta concentración de las muestras en un mismo grupo, con algunos pocos elementos dispersos (Figura 3). El ANOSIM mostró que las diferencias significativas en la densidad se presentaron mayormente entre Isla Isabel y Bahía Chamela (R = 0.543; p < 0.05) y la menor entre Islas Marietas y Bahía Chamela (R = 0.162; p < 0.05). De la misma manera, la biomasa tuvo mayor diferencia entre Isla Isabel y Bahía Chamela (R = 0.525; p < 0.05) y la menor entre Islas Marietas y Bahía Chamela (R = 0.133; p < 0.05).
Mediante los análisis SIMPER se encontraron diferencias en las especies que más contribuyen a la abundancia y biomasa de peces en cada una de las AMPs (Figura 4). En la Isla Isabel, el 90.73 % de la abundancia estuvo representado por 23 especies, de éstas la más importante fue T. lucasanum (9.55 %). El 90.23 % de la biomasa de esta isla se obtuvo también con 23 especies, pero la más importante fue P. punctatus (13.82 %). En Marietas, 17 especies contribuyeron con más del 90 % de la abundancia y biomasa. En el caso de la abundancia, la especie más importante fue H. dispilus (15.97 %) y de la biomasa E. labriformis (15.32 %). En Bahía Chamela, 90.39 % de la abundancia estuvo representada por 19 especies y 91.16 % de la biomasa por 20. Al igual que en Islas Marietas, la especie que más aporto a la abundancia fue H. dispilus (14.19 %) y a la biomasa E. labriformis (12.24 %).
Heterogeneidad del ambiente y su relación con el ensamblaje de peces
Los dos parámetros estructurales usados para correlacionar las especies con las variables ambientales obtuvieron resultados distintos para cada AMP y no todas las variables ambientales presentaron correlaciones significativas. Los ANOVAS no mostraron diferencias significativas entre el porcentaje de la cobertura de roca (p > 0.05; F = 11.15) y los valores del índice de complejidad topográfica (p > 0.05; F = 0.82) entre las AMPs. Con los valores de densidad, las únicas variables ambientales con correlaciones significativas fueron las coberturas de arena, esponjas y corales blandos (p < 0.05) (Tabla 2). Para Isla Isabel, el RDA sugiere una mayor relación entre la cobertura de corales blandos y la densidad de P. punctatus, Johnrandallia nigrirostris, Lutjanus argentiventris, Canthigaster punctatissima, Acanthurus xanthopterus, Abudefduf troschelii, Scarus perrico y Arothron meleagris. En Islas Marietas, la correlación fue mayor entre la cobertura de algas y Stegastes rectifraenum, Bodianus diplotaenia, H. dispilus, C. atrilobata y E. labriformis; mientras que en Bahía Chamela, fue entre la complejidad topográfica y Cephalopholispanamensis, H. maculicauda, M. dorsalis, S. flavilatus, S. acapulcoensis, Chaetodon humeralis, Diodon holo y Cirrhitus rivulatus (Figura 5A).
Con los valores de biomasa se encontraron correlaciones significativas sólo con la cobertura de esponjas y los corales blandos (p < 0.05). En Isla Isabel se encontraron correlaciones significativas entre la cobertura de corales blandos, roca y esponjas con las especies A. xanthopterus, P. punctatus, S. rubrioviolaceus, L. argentiventris, M. dorsalis, S. perrico, F. commersonii, J. nigrirostris, T. lucasanum y A. troschelii. En Islas Marietas, la cobertura de algas con la biomasa de P. naufragium, H. passer y S. verres. En Bahía Chamela, las correlaciones significativas fueron distintas en las dos islas: en Pajarera entre la complejidad topográfica y la biomasa de H. nicholsi, H. notospilus, H. flavilatus, S. acapulcoensis, A. meleagris y H. maculicauda; y en Cocinas lo fueron algas y arena con la biomasa de C. humeralis, C. rivulatus, D. holocanthus, S. psittacinus, E. labriformis, H. chierchiae, C. atrilobata y C. panamensis (Figura 5B).
DISCUSIÓN
La conservación de la biodiversidad marina de las islas costeras del Pacífico mexicano es de gran importancia por su valor biológico y económico, particularmente la riqueza de peces de arrecife de las tres AMPs ya que representa poco más del 30 % de las especies registradas en la región (Castro-Aguirre et al. 2006). Este porcentaje es alto si se considera que las 373 especies que se conocen en la región se incluyen en una amplia variedad de hábitos de vida. Además, el gran número de especies raras presentes en los ensamblajes de muchos grupos taxonómicos dificultan llegar a inventarios completos (Jiménez-Valverde y Hortal 2003). Las especies raras, es decir, aquellas con uno o dos organismos registrados representaron poco más del 19 % del total de las especies y los porcentajes en cada una de las AMPs fueron similares. Estas especies tienen particular relevancia en los estudios ecológicos debido a que son objeto clave de las estrategias de conservación dirigidas a mantener la biodiversidad total a nivel local y regional (Flather y Sieg 2007).
La ordenación de los transectos de las tres AMPs no mostró un patrón definido según los análisis MDS, encontrándose una alta concentración de estos en un mismo grupo. Esto sugiere que existen hábitats similares en las tres AMPs donde se asocian especies comunes entre ellas. Sin embargo, cada una presentó elementos particulares debido principalmente al gran número de especies con porcentajes de contribución bajo (< 10 %) y al recambio de especies dominantes entre cada una. Las especies que contribuyen más a la diversidad por su abundancia y biomasa fueron más similares entre Islas Marietas y Bahía Chamela. Anteriormente se consideraba que Isla Isabel pertenecía al sistema de islas del Golfo de California, por lo tanto, la composición de peces debería corresponder principalmente a la provincia del Mar de Cortés (Spalding et al. 2007). Sin embargo, recientemente Robertson y Cramer (2009) examinaron la distribución geográfica de 1 135 especies de peces costeros residentes y endémicos del Pacífico Este Tropical (PET), concluyendo que la afinidad zoogeográfica de peces costeros de esta región se subdivide en sólo dos provincias: 1) la de Cortés, que incluye el Golfo de California y la porción sur de la costa Pacífica de Baja California y 2) la Panámica, que va desde la costa de Sinaloa en México hasta la costa norte de Piura en Perú. Por lo tanto, con base en este último estudio se considera que la ictiofauna de Isla Isabel también presenta una afinidad Panámica y las subdivisiones anteriormente propuestas (Walker 1960, Briggs 1974, Hastings 2000, Spalding et al. 2007) para la ictiofauna de la costa del Pacífico mexicano no están suficientemente justificadas.
Las especies Halichoeres dispilus y Stegastes flavilatus, fueron constantes con valores importantes en la densidad y biomasa de cada AMP. Esto es relevante debido a su biología, ya que ambas son especies pequeñas (< 25 cm) que están altamente asociadas a arrecifes rocosos y tienen una amplia distribución en todo el PET (Robertson y Alien 2006). Además, de acuerdo con Thomson y Gilligan (1983) son especies características de los ensamblajes de peces asociados a arrecifes rocosos de las islas costeras del Golfo de California, los cuales presentan mayor riqueza, equidad, densidad y biomasa que los arrecifes de la costa continental. También mencionan que las especies dominantes tienden a ser más pequeñas y la tasa de recambio de especies es menorentre y dentro de los hábitats, ya que existe mayor presión por competencia debido a la alta densidad.
La mayoría de los estudios sobre peces arrecifales del Pacífico mexicano han utilizado la abundancia como parámetro estructural (Aburto-Oropeza y Balart 2001, Rodríguez-Romero et al. 2005, Ramírez-Gutiérrez et al. 2007, Villegas-Sánchez et al. 2009, Galván-Villa et al. 2010, López-Pérez et al. 2012) y muy pocos la biomasa (Campos-Dávila et al. 2005). Sin embargo, la biomasa es otro atributo de la estructura de los ensamblajes que debe considerarse, por su relevancia en la estructura trófica y la capacidad de producción de los ecosistemas marinos (Anderson y Neumann 1996). El poco uso de la biomasa en la descripción de los ensamblajes de peces de arrecife está relacionado con las dificultades metodológicas para la obtención de los datos; sin embargo, la estimación de la longitud de los peces mediante conteos visuales es una técnica que ofrece ventajas como ser repetible, rápida, de bajo costo y permite obtener una gran cantidad de datos por una sola persona (English et al. 1997); por el contrario, requiere de un entrenamiento especial y tiene un margen de error que varía en función de este último (Bell et al. 1985). A pesar de esto, la estimación de tallas mediante conteos visuales ha sido utilizada para la evaluación y monitoreo de peces arrecifales (García-Charton et al. 2004, Newman et al. 2006, Giakoumi y Kokkoris 2013).
El uso de la biomasa como medida estructural permitió reconocer las especies que presentaron la mayor contribución por su biomasa en los sistemas insulares estudiados. Por ejemplo, la cabrilla Ephinephelus labriformis ocupó el primer lugar en el porcentaje de contribución en las Islas Marietas y de Bahía Chamela. En trabajos anteriores E. labriformis no ha sido considerada como una especie relevante en la estructuración del ensamblaje de peces en los arrecifes rocosos del Pacífico mexicano, aunque es una especie que frecuentemente se captura en la pesquería artesanal de la región (Ramírez y Rodríguez 1990, Ríos-Jara et al. 2001) y que se ha utilizado en estudios sobre relaciones filogeográficas de peces del PET (Craig et al. 2006). Debido a esto, posiblemente esta y otras especies pudieron ser subestimadas en trabajos anteriores donde realizan evaluaciones de peces solo con valores de abundancia numérica.
Aunque las características ambientales de las islas del Pacífico central mexicano son similares, la estructura de los hábitats da como resultado ambientes localmente distintos y esta variabilidad contribuye a aumentar el número de endemismos (Choat y Bellwood 1991). La cobertura de roca y la complejidad topográfica son predictores utilizados para determinar la riqueza de peces en ambientes marinos del Pacífico mexicano, principalmente en aquellos donde la cobertura de coral no es el principal elemento estructural del hábitat bentónico (Aburto-Oropeza y Balart 2001, Campos-Dávila et al. 2005, Galván-Villa et al. 2010). Los sustratos rocosos ofrecen estabilidad en el fondo marino, que permite el desarrollo y permanencia de algas micro y macroscópicas, corales, esponjas y una gran variedad de organismos sésiles y semi-sésiles (Gratwicke y Speight 2005).
La complejidad topográfica en algunos casos llamada rugosidad o relieve del fondo como descriptor de la riqueza es más variable. En arrecifes de coral se ha encontrado que la complejidad es uno de los principales elementos relacionados con la diversidad de peces (Chabanet et al. 1997). Por el contrario, estudios en arrecifes rocosos han demostrado que la complejidad topográfica juega un papel importante en la distribución de los peces, principalmente en el Indo-Pacífico y el Mar Caribe (Gratwicke y Speight 2005). En las islas bajo estudio la cobertura de roca y la complejidad topográfica no presentaron correlación significativa con las especies, debido posiblemente a que no se presentan diferencias en los porcentajes de cobertura entre las tres AMPs y a esta escala espacial no se pueden tomar como variables explicativas de la distribución de los peces. Por el contrario, la cobertura de esponjas, arena y corales blandos estuvieron correlacionados significativamente con algunas especies dominantes. Se ha encontrado que la cobertura de corales blandos es un elemento que contribuye a la variación en la composición de especies en arrecifes de coral del Caribe mexicano (Arias-González et al. 2008). Estos resultados contrastan con otros trabajos realizados endistintos sitios del Pacífico mexicano donde los elementos estructurales del hábitat que más influyen en la distribución espacial de peces son la cobertura de corales y roca, así como la complejidad topográfica y disponibilidad de refugio (Galván-Villa et al. 2010, Rodríguez-Zaragoza et al. 2011, López-Pérez et al. 2012). Por lo tanto, para la determinación de la distribución de los peces en estas islas, estos elementos estructurales pueden ser diferentes dependiendo de la escala espacial que se maneja. Un factor ambiental importante a considerarse en trabajos posteriores es la evaluación del efecto que tienen los cambios de temperatura del agua por los fenómenos ENSO (El Niño-La Niña/Southern Oscillation), los cuales pueden causar cambios importantes en las comunidades de peces (Victor et al. 2001). Según registros de la NOAA (2013), durante los muéstreos en Isla Isabel se registró un aumento de temperatura en octubre de 2004 de 0.7 °C sobre la media. Por el contrario, en las islas Marietas para los años 2008 y 2009 se registraron disminuciones en la temperatura de -0.5 °C; y en las islas de Chamela en 2007 una disminución de -1.2 °C. Sin embargo, en este trabajo no se valoró el efecto por los cambios en la temperatura del agua sobre la presencia y abundancia de las especies.
Los resultados indican que en cada uno de los sistemas insulares influyen distintos elementos estructurales del hábitat lo cual se refleja en la composición de las especies de peces residentes de cada uno de ellos. Además, el uso de tres índices estructurales (riqueza, abundancia y biomasa) permitió tener una descripción detallada de la comunidad ictiológica de cada sitio, resaltando especies de interés científico y con potencial comercial para la región. Finalmente, se resalta que Isla Isabel presenta mayor riqueza de especies y biomasa, lo que puede ser debido a la complejidad estructural de sus arrecifes y la distancia que la separa de la costa. Esta separación le permite soportar una gran cantidad de peces de tallas grandes, como lo proponen Thomson y Gilligan (1983) para las islas del Golfo de California.
CONCLUSIONES
Por lo tanto, en las islas más alejadas de la costa se pueden encontrar peces de tallas mayores que en puntos cercanos a la misma, lo que puede ser un efecto de la presión ejercida por las actividades de pesca y turismo que se realizan en islas más accesibles como las Islas Marietas y las islas de Bahía Chamela.
AGRADECIMIENTOS
A E. Ríos, F. Rodríguez, C. González y J. Tovar por sus comentarios y sugerencias a la primera versión del escrito. A J. Castrejón, G. Lozano, C. Robles (CONANP-San Blas) por su apoyo en las salidas a la isla Isabel. Al personal de Vallartech (Pto.Vallarta) por su ayuda en las salidas a islas Marietas y a J. Vega, jefe de la estación de Biología Chamela (IBUNAM), por las facilidades otorgadas durante los muéstreos en Bahía Chamela. Los fondos para este trabajo fueron otorgados por la Universidad de Guadalajara (Proyecto P3E-2009), la CONABIO (Proyecto BK018) y la beca de posgrado de CONACYT-México (No. 241329).
LITERATURA CITADA
Aburto-Oropeza O, Balart EF (2001) Community structure of reef fish in several habitats of a rocky reef in the Gulf of California. Marine Ecology 22: 283-305.
Álvarez-Filip L, Reyes-Bonilla H, Calderón-Aguilera LE (2006) Community structure of fishes in Cabo Pulmo Reef, Gulf of California. Marine Ecology 27: 253-262.
Anderson RO, Neumann RM (1996) Length, weight, and associated structural indices. En: Murphy BR, Willis DW (eds) Fisheries Techniques. American Fisheries Society, Bethesda. 732 p.
Arias-González JE, Legendre P, Rodríguez-Zaragoza FA (2008) Scaling up beta diversity on Caribbean coral reefs. Journal of Experimental Marine Biology and Ecology 366: 28-36.
Bell JD, Craik GJS, Pollard DA, Russell BC (1985) Estimating length frequency distributions of large reef fish underwater. Coral Reefs 4: 41-44.
Bellwood DR, Wainwright PC (2002) The history and biogeography of fishes on coral reefs. En: Sale PF (ed) Coral Reef Fishes: Dynamics and diversity in a complex ecosystem. Academic Press, San Diego, CA. 549 p.
Briggs JC (1974) Marine zoogeography. New York: McGraw-Hill. 475 p.
Brown JH, Lomolino MV (1998) Biogeography. Sinauer, Massachusetts. 764 p.
Campos-Dávila L, Cruz-Escalona VH, Galván-Magaña F, Abitia-Cárdenas A, Gutiérrez-Sánchez FJ, Balart EF (2005) Fish assemblages in a gulf of California marine reserve. Bulletin of Marine Science 77: 347-362.
Castro-Aguirre JL, González-Acosta AF, De La Cruz-Agüero J, Moncayo-Estrada R (2006) Ictiofauna marina-costera del Pacífico central mexicano: análisis preliminar de su riqueza y relaciones biogeográficas. En: Jiménez-Quiroz MC, Espino-Barr E (eds). Los recursos pesqueros y acuícolas de Jalisco, Colima y Michoacán. SAGARPA, México. 622 p.
Chabanet P, Ralambondrainy H, Amanieu M, Faure G, Galzin R (1997) Relationship between coral reef substrata and fish. Coral Reefs 16: 93-102.
Choat JH, Bellwood DR (1991) Reef fish: their ecology and evolution. En: Sale PF (ed) The ecology of fishes on coral reefs. Academic Press, San Diego, USA. 754 p.
Clarke KR (1993) Non-parametric multivariate analyses of changes in community structure. Australian Journal of Ecology 18: 117-143.
Clarke KR, Gorley RN (2006) Primer v6: user manual/tutorial. United Kingdom: Primer-E Ltd. Plymouth. 190 p.
Clarke KR, Warwick RM (2001) Change in marine communities: An approach to statistical analysis and interpretation. United Kingdom: Primer-E Ltd. Plymouth. 172 p.
Colwell RK (2006) EstimateS: statistical estimation of species richness and shared species from samples. http.//viceroy.eeb.uconn.edu/estimates. Fecha de consultado el 12 de agosto de 2012.
Craig MT, Hastings PA, Pondella DJ, Robertson DR, Rosales-Casián JA (2006) Phylogeography of the flag cabrilla Epinephelus labriformis (Serranidae): implications for the biogeography of the Tropical Eastern Pacific and the early stages of speciation in a marine shore fish. Journal of Biogeography 33: 969-979.
Del Moral-Flores LF, González-Acosta AF, Espinoza-Pérez H, Ruiz-Campos G, Castro-Aguirre JL (2013) Lista anotada de la ictiofauna de las islas del golfo de California, con comentarios sobre sus afinidades zoogeográficas. Revista Mexicana de Biodiversidad 84: 184-214.
English S, Wilkinson C, Baker V (1997) Survey manual for tropical marine resources. Australian Institute of Marine Science, Townsville. 390 p.
Flather CH, Sieg CH (2007) Species rarity: definition, causes, and classification. En: Raphael MG, Molina R (eds) Conservation of rare or little known species: biological, social, and economic considerations. Island Press, Washington, D.C., USA. 392 p.
Froese R, Pauly D (2014) FishBase. www.fishbase.org. Consultado el 2 de septiembre de 2012.
Galván-Villa CM, Arreola-Robles JL, Ríos-Jara E, Rodríguez-Zaragoza FA (2010) Ensamblajes de peces arrecifales y su relación con el habitat bentónico de la Isla Isabel, Nayarit, México. Revista de Biología Marina y Oceanografía 45: 311-324.
García-Charton JA, Pérez-Ruzafa A, Sánchez-Jerez P, Bayle-Sempere JT, Reñones 0, Moreno D (2004) Multi-scale spatial heterogeneity, hábitat structure, and the effect of marine reserves on Western Mediterranean rocky reef fish assemblages. Marine Biology 144: 161-182.
Giakoumi S, Kokkoris GD (2013) Effects of habitat and substrate complexity on shallow sublittoral fish assemblages in the Cyclades Archipelago, North-eastern Mediterranean sea. Mediterranean Marine Science 14: 58-68.
Gladstone W (2007) Requirements for marine protected areas to conserve the biodiversity of rocky reef fishes. Aquatic Conservation 17: 71-87.
Gratwicke B, Speight MR (2005) The relationship between fish species richness, abundance, and habitat complexity in a range of shallow tropical marine habitats. Journal of Fish Biology 66: 650-667.
Hastings PA (2000) Biogeography of the tropical Eastern Pacific: distribution and phylogeny of chaenopsid fishes. Zoological Journal of the Linnaean Society of London 128: 319-335.
Hill MO (1973) Diversity and evenness: a unifying notation and its consequences. Ecology 54: 427-432.
Jiménez-Valverde A, Hortal J (2003) Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología 8: 151-161.
Leis RN (1984) Larval fish dispersal and the East Pacific Barrier. Océanographie Tropicale 19: 181-192.
López-Pérez RA, Calderón-Aguilera LE, Zepeta-Vilchis RC, López-Pérez Maldonado I, López-Ortiz AM (2012) Species composition, habitat configuraron and seasonal changes of coral reef fish assemblages in western México. Journal of Applied Ichthyology 29: 437-448.
Marks KW, Klomp KD (2003) Fish biomass conversión equations. Atoll Research Bulletin 496: 625-628.
Newman MJ, Paredes GA, Sala E, Jackson JBC (2006) Structure of Caribbean coral reef communities across a large gradient of fish biomass. Ecology Letters 9: 1216-1227.
NOAA (2013) Coid and warm episodes by season. http://www.cpc.ncep.noaa.gov/products/analysis_monitoring/ensostuff/ensoyears.shtml. Fecha de consulta 10 de agosto de 2013.
Ramírez RM, Rodríguez CM (1990) Specific composition of the small scale fishery capture at Isla Cerralvo, BCS, México. Investigaciones Marinas 5: 137-141.
Ramírez-Gutiérrez M, Tapia-García M, Ramos-Santiago E, Ulloa R (2007) Fish community structure in San Agustín Bay, Huatulco, México. Revista Chilena de Historia Natural 80: 419-430.
Rao CR (1995) A review of canonical coordinates and an alternative to correspondence analysis using Hellinger distance. Qüestiió 19: 23-63.
Risk MJ (1972) Fish diversity on a coral reef in the Virgin Islands. Atoll Research Bulletin 193: 1-6.
Ríos-Jara E, Pérez-Peña M, Juárez-Carrillo E, López-Uriarte E (2001) Recursos pesqueros de la costa de Jalisco. Universidad de Guadalajara, México. 159 p.
Robertson DR, Alien GR (2006) Peces costeros del Pacífico Oriental Tropical: un sistema de información. Versión 2.0. Instituto Smithsonian de Investigaciones Tropicales, Balboa.
Robertson DR, Cramer KL (2009) Shore fishes and biogeographic subdivisions of the Tropical Eastern Pacific. Marine Ecology Progress Series 380: 1-17.
Rodríguez-Romero J, Muhlia-Melo AF, Galván-Magaña F, Gutiérrez-Sánchez FJ, Gracia-López V (2005) Fish assemblages around Espiritu Santo Island and Espiritu Santo Seamount in the lower Gulf of California, México. Bulletin of Marine Science 77: 33-50.
Rodriguez-Zaragoza FA, Cupul-Magaña AL, Galván-Villa CM, Ríos-Jara E, Ortiz M, Robles-Jarero EG, López-Uriarte E, Arias-González JE (2011) Additive partitioning of reef fish diversity variation: a promising marine biodiversity management tool. Biodiversity and Conservation 20: 1655-1675.
Sale PF (2002) Coral Reef Fishes. Dynamics and diversity in a complex ecosystem. Academic Press, San Diego, USA. 549 p.
Spalding MD, Fox HE, Alien GR, Davidson N, Ferdana ZA, Finlayson M, Halpern BS, Jorge MA, Lombana A, Lourie SA, Martin KD, McManus E, Molnar J, Recchia CA, Robertson J (2007) Marine ecoregions of the world: a bioregionalization of Coastal and shelf areas. Bioscience 57: 573-582.
ter Braak CJF, Smilauer P (2002) CANOCO Reference Manual and CanoDraw for Windows Users Guide: Software for Canonical Community Ordination. Microcomputer Power, Ithaca, New York. 500 p.
Thomson DA, Gilligan M (1983) The rocky-shore fishes. En: Case TJ, Cody ML, Ezcurra E (eds) A new island biogeography in the Sea of Cortez. Oxford University Press, New York, USA. 688 p.
Victor BC, Wellington GM, Robertson DR, Ruttenberg Bl (2001) The effect of the El Niño-Southern Oscillation event on the distribution of reefassociated labrid fishes in the Eastern Pacific Ocean. Bulletin of Marine Science 69: 279-288.
Villegas-Sánchez CA, Abitia-Cárdenas LA, Gutiérrez-Sánchez FJ, Galván-Magaña F (2009) Rocky-reef fish assemblages at San José Island, México. Revista Mexicana de Biodiversidad 80: 169-179.
Walker BW (1960) The distribution and affinities of the marine fish fauna of the Gulf of California. Systemtic Zoology 9: 123-133.
Whittaker RJ, Fernandez-Palacios JM (2007) Island Biogeography: Ecology, evolution, and conservation. Oxford University Press, New York. 285 p.
WWF (2006) Mejores prácticas de pesca en arrecifes coralinos. Guía para la colecta de información que apoye el manejo de pesquerías basado en ecosistemas. WWF, México/Centroamérica. 83 p.