Articulo Cientifico
SEROPREVALENCIA DE ENFERMEDADES QUE AFECTAN LA REPRODUCCIÓN DE BOVINOS PARA LECHE CON ÉNFASIS EN NEOSPOROSIS
Seroprevalence of reproductive diseases that affect dairy cattle with emphasis on neosporosis
Juan José Ojeda-Carrasco1*, Enrique Espinosa-Ayala1, Pedro Abel Hernández-García1, Carmen Rojas-Martínez2, Jesús Antonio Álvarez-Martínez2,
1 Universidad Autónoma del Estado de México. Centro Universitario Amecameca. Carretera Amecameca-Ayapango Km 2.5, CP. 56900 Amecameca, Estado de México, México. *Autor de correspondencia: jjojedac@uaemex.mx, mvzojeda@hotmail.com
2 Centro Nacional de Investigación Disciplinaria en Parasitología Veterinaria, INIFAP. Carretera Federal Cuernavaca-Cuautla No. 8354 Col. Progreso, CP. 62550, Jiutepec, Morelos. México.
Nota científica recibido el 04 de marzo de 2015
Aceptado el 20 de mayo de 2015
RESUMEN
El objetivo fue estimar la sero prevalencia de neosporosis, diarrea viral bovina, rinotraqueítis infecciosa bovina, brucelosis y leptospirosis; así como, determinar su asociación con el antecedente de aborto e identificar los factores de riesgo. Mediante un estudio de casos y controles de 29 unidades de producción, se seleccionaron 57 vacas con antecedente de aborto y 121 controles. Se analizaron por serología y fetos abortados por PCR para N. caninum. Excepto para brucelosis, se detectaron vacas seropositivas correspondiendo la mayor seroprevalencia a N. caninum (51.7%) y la menor (11.8 %) para Leptospirosis. 11.8 % de las vacas fueron seropositivas a N. caninum y diarrea viralbovina de manera simultánea, presentando el 100% de ellas registros de al menos un aborto. Se comprobó la presenciade ADN de N. caninum en un feto, concluyéndose que N. caninum es causa determinante en la presentación de abortoen el sistema de producción de leche en pequeña escala.
Palabras clave: Enfermedades abortivas, factores de riesgo, neosporosis, pequeña escala, seroprevalencia
ABSTRACT
The objective of this article was to estimate the seroprevalence of neosporosis, bovine viral diarrhea, infectious bovine rhinotracheitis, brucellosis, and leptospirosis, as well as to determine their association with the history of miscarriage and to identify the risk factors. By means of a case-control study of 29 production units, 57 cows with a history of miscarriage were selected alongside another 121 cows as controls. These cows were analyzed by serologyand the aborted fetuses were analyzed by PCR for N. caninum. Except for brucellosis, cows were detected seropositive with the most seroprevalence corresponding to N. caninum (51.7 %) and the least seroprevalence corresponding toleptospirosis (11.8 %). 11.8 % of the cows were simultaneously seropositive for N. caninum and bovine viral diarrhea, with 100% of them showing records of at least one miscarriage. The DNA presence of N. caninum in one fetus wasproven, concluding that N. caninum is a determinant cause in the occurrence of miscarriage in the milk productionsystem on a small scale.
Keywords: Abortifacient diseases, risk factors, neosporosis, small scale, seroprevalence
INTRODUCCIÓN
El aborto, es una de las principales causas que afecta la economía y competitividad de la producción lechera (Selim et al. 2014), se considera normal una tasa de 2 a 6.5 % al año (Forar et al. 1995). Determinar la causa del aborto es complejo, y sólo se puede identificar entre 25 y 40 % de las veces, aun cuando se cuente con muestras del feto, pero se sabe que los agentes infecciosos pueden estar involucrados hasta en 90 % de las veces (Yang et al 2012). En México, más del 70 % de los abortos.
Se clasifican como de origen desconocido (Escamilla et al. 2007). Cuando no se dispone de tejido fetal para los análisis de laboratorio, el diagnóstico se realiza por medio de pruebas serológicas con las quese detectan anticuerpos circulantes contra agentes infecciosos como Neospora caninum, el virus de ladiarrea viral bovina (DVB) y de la rinotraqueítis infecciosa bovina (IBR), brucelosis y leptospirosis. Si nembargo, una de las principales limitantes de estetipo de determinaciones es que es difícil diferenciar entre los anticuerpos producidos por la inmunización y los estimulados por la infección natural (Abas et al. 2014). A partir de información de seropreva-lencias obtenidas de ganado sano y de vacas con problemas de abortos, es posible precisar la probabilidad relativa de aborto y la proporción de aborto satribuibles a una enfermedad en específico (Thrus-field 2007). En particular, se sabe que N. caninum es un protozoo de relevancia en la producción de abortos a nivel mundial y aunque se desconoce el impacto económico global que produce, existen investigaciones en las que se atribuyen pérdidas de entre 20 y 110 dólares en vacas productoras de leche infectadas durante la gestación (Reichel et al. 2013).
En México 78.6 % de las unidades de producción tienen menos de 30 vacas, las cualesrepresentan 34.7 % del inventario de bovinos productores de leche, que a su vez aportan 25.5 % dela producción nacional (INEGI 2007). Con base enlo anterior, el objetivo del presente trabajo fue estimar la seroprevalencia de neosporosis, DVB, IBR,brucelosis y leptospirosis; para determinar su asociación con el antecedente de aborto e identificarlos factores de riesgo.
MATERIALES Y MÉTODOS
El trabajo se realizó en los municipios de Amecameca, Tlalmanalco y Ayapango en el suroriente del Estado de México, a una altura promedio de 2420 msnm. El clima es templado subhúmedo con lluvias en verano Cb (w2), temperatura media de12 a 18 °C y precipitación pluvial de 935 mm al año (INEGI 2008).
Selección de las unidades de producción de leche(UPL)
De 149 UPL totales, se seleccionaron 29 mediante un muestreo doble estratificado por conveniencia, el primer estrato correspondió a la representación proporcional de cada municipio y el segundo, al número de animales en lactación (I) 3-7 vacas, (II) 8-15 vacas y (III) más de 16 vacas (Espinoza-Ortega et al. 2007). El manejo reproductivo, nutricional y sanitario se efectuó de acuerdo con el productor. Para cada UPL se levantó una encuesta con el propósito de identificar factores deriesgo individual y de hato, relacionados con la presentación de aborto.
Tamaño de muestra
Se empleó un diseño de casos y controles, a partir de un total de 331 vacas; se seleccionaron 178, cada animal con antecedente de aborto fue un caso (n=57) y los controles fueron aquellas vacas sin historial de abortos (n=121) (Mateu y Casal 2003).
Muestreo
De cada animal se recolectó una muestra sanguínea por punción de la vena coccígea en tubos sin anticoagulante, posteriormente se centrifugó a 1000 x g por 15 min, se separó el suero y se colocó en viales de poliestireno para guardar a -20 °C hasta su uso.
Pruebas serológicas
Para la detección de anticuerpos específicos para N. caninum, DVB e IBR se utilizó el ensayo inmunoenzimático (ELISA), cada muestra se trabajó por duplicado empleando paquetes comerciales (HerdCheck anti-N/. caninum, HerdCheck BVDB y HerdCheck IBR-gB. IDEXX™-Laboratories Inc., Westbrook, Maine USA). Se usó un lector BIORAD con lectura de absorbancia de 650 nm para N. caninum y de 450 nm para DVB e IBR. Los procedimientos y punto de corte se efectuaron de acuerdo al fabricante. La presencia de anticuerpos para Leptospira spp. se verificó con la pruebade microaglutinación (MAT) con una batería de 10 serovariedades de referencia internacional y tres de aislamientos nacionales; se consideraron como positivos títulos mayores o iguales a 1:100 (Salgado et al. 2014). Para el diagnóstico de brucelosis se utilizó la prueba de aglutinación en placa con rosa debengala y la de Rivanol como prueba confirmatoria (NOM-041-ZOO-1995). El criterio para considerarcomo aborto fue la pérdida de la preñez entre los 42 y 260 d de gestación.
Diagnóstico molecular para neosporosis
Para el diagnóstico se emplearon tres fetos de los cuales se obtuvieron 25 mg de tejido cerebral, renal e hígado fetal; se realizó la extracción del ADN con un paquete comercial (Ultra Clean, MoBioLab™ Se practicó el ensayo de PCR semianidado con secuencias iniciadoras publicadas previamente Np4 (5’CCTCCCAATGCGAACGAAA3'), Np7 (5’GGGTGAACCGAGGGAGTTG3’) y en el formato semianidado se incluyeron Np6 (5'CAGT-CAACCTACGTCTTCT3') y Np7. Por cada muestra se emplearon 43 de la mezcla comercial (PCR Master Mix, Promega™, USA), a la que se le agregaron 5 µL de ADN blanco y 1 µL de cada iniciador. El protocolo de amplificación fue de 95 °C por 2 min para pre desnaturalización; 95 °C por 30 s para desnaturalización, 57 °C por 30 s para alineamiento y 72 °C por 60 s para la extensión por 35 ciclos y la extensión final a 72 °C por 3 min. Los productos de la amplificación se separaron en un gelde agarosa al 1.8 % teñido con bromuro de etidio y se visualizaron con luz ultravioleta (UV). El tamaño esperado del amplicón fue de 275 pares de bases (pb) (Bazler et al. 1999).
Análisis estadístico
Los valores de prevalencia del grupo de vacas con aborto y del grupo control fueron comparados mediante Ji cuadrada con corrección de Yates. Para medir la fuerza de asociación entre seropositividad y antecedente de aborto se calculó la oportunidad relativa con intervalos de confianza (IC) del 95 %, donde valores mayores a uno indicaron asociación (Thrusfield 2007). La fracción atribuible poblacional (λfap) se determinó usando el método para estudios de casos y controles, asumiendo que el grupo control fue representativo para la poblaciónen estudio (Gordis 2005). Los factores evaluados de riesgo individual y de hato se consideraron como variables dicotómicas, excepto en las que se hizo descripción de la variable. Los factores individuales fueron: resultado serológico de positividad o negatividad a neosporosis, DVB, IBR, brucelosis y leptospirosis; número de enfermedades a las que fueron positivos los animales (1, 2, > 3); antecedente de aborto, número de abortos y número de partos (1, 2, > 3). Los factores de hato fueron: procedencia de los reemplazos, presencia de perros en el establo, antecedentes de vacunación, encharcamientos en las instalaciones y tipo de servicio. El análisis inicial se realizó mediante Ji cuadrada y en aquellas en que el factor de riesgo fue significativo (p <0.05), se procesaron con regresión logística por el procedimiento LOGISTIC del programa SAS versión 9.0.
RESULTADOS Y DISCUSIÓN
El número de hembras en edad reproductiva en las UPL fue de 4 a 49, promedio de 11.4; con rango de edad de 1 a 13 años (4.7 ± 2.4 años), con 0 a 10 10 partos con media de 2.3 ± 1.8 partos. El reducido tamaño del hato indica que las UPL pertenecen al sistema de producción de leche de pequeña escala. En ninguna de las UPL se realizan programas preventivos de inmunización contra los principales agentes etiológicos relacionados con abortos.
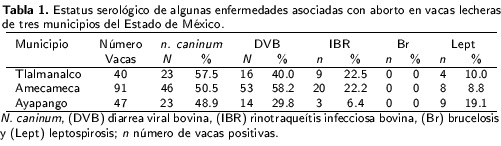
Se detectó la presencia de anticuerpos de agentes relacionados con la producción de abortosen bovinos (Tabla 1) sin embargo, es conveniente considerar que en este tipo de estudios, los resultados serológicos dependen de la prevalencia de la infección en un contexto de temporalidad y distribución espacial definida, así como de la persistencia de anticuerpos circulantes en el animal, las tasas de sensibilidad y especificidad epidemiológicas de las pruebas empleadas. La prevalencia de N. caninum fue de 51.7 %, lo cual es similar a lo reportado por Morales et al. (2001). En sis temas especializados, también, se ha encontrado alta prevalencia en ganado lechero de los estadosde Coahuila y Aguascalientes (Salinas et al. 2005, Meléndez et al. 2010); lo que difiere de lo encontrado en ganado Bos indicus en el trópico húmedo en el que se reporta una prevalencia de 8 a 15 % (García-Vázquez et al. 2009); mientras que en vacas con antecedentes de aborto se reporta una prevalencia del 20 % (Montiel-Peña et al. 2011). Lo encontrado en el presente estudio para N. caninum evidencia un comportamiento similar entre el sistema deproducción en pequeña escala e intensivos (Morales et al. 2001, Gavrea et al. 2011). La prevalencia de 46.6 % para DVB, contrasta con lo reportado por Moles et al. (2002), quienes reportan una prevalencia del 72.3 % en bovinos lecheros, al respecto se sabe que este virus induce inmuno supresión y sea socia con la disminución en la productividad, pérdidas reproductivas y predisposición a la infección por otros agentes como lo es el caso de la neosporosis (Dubey et al. 2007); asimismo puede ocurrir muerte fetal, aborto, momificación y nacimiento debecerros inmunotolerantes (Brodersen 2014). En el presente estudio se observó que 11.8 % de las vacas fueron seropositivas para N. caninum y DVB, presentando 100 % de estas vacas con al menos un aborto. Para IBR, 18 % de los animales fueron seropositivos, lo cual coincide con Magaña-Urbina et al. (2005) quienes reportan una tasa del 22 % en bovinos de traspatio. En el caso de Leptospira spp. se estimó una prevalencia del 11.8 %, lo que es similar a lo reportado por León et al. (2008); mientras que el 47.6 % de las vacas positivas presentaron anticuerpos contra la serovariedad L. hardjo; también se detectó la presencia de las serovares L. canteóla, L. icterohemorragiae, L. wolffi y L. pyrogenes. No se encontraron anticuerpos contra B. abortus en las vacas muestreadas, aunque existe un programa nacional para su control, en el ganado estudiado no se realizan actividades preventivas, ni de control contra la brucelosis, lo cual contrasta con lo reportado a nivel nacional y para el Estado por el Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA) (2013).
Al comparar las vacas con antecedente de aborto y el grupo control para N. caninum, DVB, IBR, brucelosis y leptospirosis, sólo se encontraron diferencias significativas para N. caninum (P =0.00001) con un OR = 5.15 (IC 95 %: 2.06, 12.86) y la fracción poblacional (λfap) de 0.232 (Tabla 2) el OR indicó que el ganado seropositivo a N. caninum y con antecedente de aborto, tuvo 5.1 veces más posibilidad de abortar que el ganado no infectado (García-Vázquez et al. 2005, González-Warleta et al. 2007). La fracción atribuible poblacional para N. caninum indicó que 23.2 % de los abortos en el ganado bajo estudio pueden ser atribuidos a este parásito, por lo que este porcentaje de abortos puede disminuir si el parásito se controla o erradica.
El análisis de los factores de riesgo individual, mediante Ji cuadrada mostró asociación entre las vacas con antecedente de aborto y la presencia de anticuerpos para N. caninum (p < 0.05). De forma similar, entre la seropositividad simultánea a N. caninum y DVB, para los factores de riesgo de hato, se encontró asociación entre antecedente de aborto y la presencia de perros en el establo OR = 13.07 (IC 95 %: 4.7; 36) (p = 0); o bien, con la presencia de encharcamientos en las instalaciones OR = 0.46 (IC 95 %: 0.91; 1.07) (p = 0.0315). El análisis de regresión logística, no detectó asociación entre los factores individuales y de hato con la presentación de aborto, lo cual coincide con lo reportado (Bartels et al. 2007, Meléndez et al. 2010).
Durante el estudio se registraron 43 abortos, la mayor proporción ocurrió en el segundo tercio de gestación, seguido por el primero y último tercio (60.5 %, 20.9 %, 18.6 %, respectivamente). De tres fetos abortados de vacas seropositivas a N. caninum, se obtuvieron porciones de encéfalo, riñón e hígado; en el encéfalo de uno de ellos se identificó el ADN de N. caninum (Figura 1); lo que sugiere una infección activa por la transmisión vertical de la vaca a la cría y horizontal del perro a la vaca, lo cual permite mantener el ciclo del parásito, por lo que es necesario realizar más investigación sobre este tema (Bartels et al. 2007, Montiel-Peña et al. 2011). Se concluye que existe la presencia de los agentes etiológicos de DVB, IBR, neosporosis, y leptospirosis, con amplia distribución en las UPL del sistema familiar de producción de leche, en los municipios bajo estudio del Estado de México. La presencia de N. caninum es una causa determinanteen la presentación de aborto infeccioso al encontrar un alto porcentaje de vacas seropositivas, al descubrir la presencia de ADN del parásito en un feto abortado. Este tipo de estudios pueden facilitar la implementación y diseño de programas de prevención y/o control de enfermedades infecciosas para mejorar la competitividad de la actividad pecuaria del sistema familiar de producción de leche.
AGRADECIMIENTOS
Así como a los productores por las facilidades otorgardas Al CONACYT por la beca para estudios de gadas para la realización de la investigación, posgrado. A la Universidad Autónoma del Estadode México por el financiamiento de los proyecto 3161/2012/ESP y DSA/103.5/14/7529 de la SEP.
LITERATURA CITADA
Abas KA, Lichtman AH, Pillai S (2014) Cellular and Molecular Immunology. 8th Edition, Elsevier Saunders, USA. 525p.
Bartels C, Huinink I, Beiboer M, Van Schaik G, Wouda W, Dijkstra T, et al. (2007) Quantification of vertical and horizontal transmission of Neospora caninum infection in dutch dairy herds. Veterinary Parasitology148: 83-92
Bazler TV, Gay JC, Long MT, Mathison BA (1999) Detection by PCR of Neospora caninum in Fetal Tissues from Spontaneus Bovine Abortions. Journal Clinical Microbiology 37: 4059-4064
Brodersen BW (2014) Bovine viral diarrhea virus infections: manifestations of infection and recent advances in understanding pathogenesis and control. Veterinary Pathology 51: 453-464.
Dubey JP, Schares G, Ortega-Mora LM (2007) Epidemiology and control of neosporosis and Neospora caninum. Clinical Microbiology Reviews 20: 323-367
Escamilla HP, Martínez MJJ, Medina M, Morales SE (2007) Frequency and causes of infectious abortion in a dairy herd in Queretaro, Mexico. The Canadian Journal of Veterinary Research 71: 314-317
Espinoza-Ortega A, Espinosa-Ayala E, Bastida-López J, Castañeda-Martínez T, Arriaga-Jordán CM (2007) Small-scale dairy farming in the highlands of central Mexico: technical, economic and social aspectsand their impact on poverty. Experimental Agriculture 43: 241-256
Forar AL, Gay JM, Hancock DD (1995) The frequency of endemic fetal loss in dairy cattle: a review. Theriogenology 43: 989-1000.
García-Vázquez Z, Rosario-Cruz R, Ramos-Aragón A, Cruz-Vázquez C, Mapes-Sánchez G (2005) Neospora caninum seropositivity and association with abortions in dairy cows in Mexico. Veterinary Parasitology134: 61-65.
García-Vázquez Z, Rosario-Cruz R, Mejía-Estrada F, Rodríguez-Vivas I, Romero-Salas D, Fernández-Ruvalcaba M, et al. (2009) Seroprevalence of Neospora caninum antibodies in beef cattle in three southern statesof Mexico. Tropical Animal Health and Production 41: 749-753.
Gavrea RR, lovu A, Losson B, Cozma V (2011) Seroprevalence of Neospora caninum in dairy cattle from north-west and centre of Romania. Parasite 18: 349-351
González-Warleta M, Castro-Hermida MJA, Carro-Corral C, Cortizo-Mella J, Mezo M (2008) Epidemiology of neosporosis in dairy cattle in Galicia (NW Spain). Parasitology Research 102: 243-249.
Gordis L (2005) Epidemiología. Tercera Edición. Elsevier, España. 336p.
INEGI. Instituto Nacional de Estadística y Geografía (2007) Censo Agrícola, Ganadero y Forestal. http://www.inegi.org.mx. Fecha de consulta 23 de febrero de 2014.
INEGI. Instituto Nacional de Estadística y Geografía (2008) Anuario Estadístico del Estado de México, http://cuencavalledemexico.com/informacion/estatal/estado-de-mexico/medio-natural/. Fecha de consulta 16 de junio de 2014.
León LL, García RC, Díaz CO, Valdez RB, Carmona GC, Velázquez BL (2008) Prevalence of leptospirosis in dairy cattle from small rural production units in Toluca Valley, State of Mexico. Annals New YorkAcademic Science 1149: 292-295
Magaña-Urbina A, Solorio-Rivera JL, Segura-Correa JC (2005) Rinotraqueítis infecciosa bovina en hatos lecheros de la región Cutzio-Téjaro, Michoacán, México. Técnica Pecuaria México 43: 27-37
Mateu E, Casal J (2003) Tamaño de la muestra. Revista de Epidemiología y Medicina Preventiva 1: 8-14
Meléndez RM, Valdivia AG, Rangel EJ, Díaz E, Segura-Correa JC, Guerrero AL (2010) Factores de riesgo asociados a la presencia de aborto y desempeño reproductivo en ganado lechero de Aguascalientes,México. Revista Mexicana de Ciencias Pecuarias 1: 391-401.
Moles LP, Gavaldón D, Torres JI, Cisneros MA, Aguirre J, Rojas N (2002) Seroprevalencia simultanea de Leptospirosis y tres enfermedades de importancia reproductiva en bovinos del altiplano central de laRepública Mexicana. Revista Salud Animal 24: 106-110
Montiel-Peña T, Romero-Salas D, García-Vázquez Z, Medina-Esparza L, Cruz-Vázquez C (2011) Bovine neosporosis in cattle farms from the northern region of the state of Veracruz, Mexico. Tropical andSubtropical Agroecosystems 13: 469-479
Morales E, Trigo FJ, Ibarra F, Puente E, Santacruz M (2001) Seroprevalence study of bovine neosporosis in Mexico. Journal Veterinary Diagnostic Investigation 13: 413-415
NOM-041-ZOO-1995. Secretaría de Agricultura, Ganadería y Desarrollo Rural. Norma Oficial Mexicana NOM-041-ZOO-1995, Campaña Nacional contra la Brucelosis en los Animales. Diario Oficial. México,DF. 22p.
Reichel MP, Ayanequi-Alcérreca MA, Gondim LF, Ellis JT (2013) What is the global economic impact of Neospora caninum in cattle - the billion dollar question. International Journal for Parasitology 43:133-142
Salgado M, Otto B, Sandoval E, Reinhardt G, Boqvist S. (2014) A cross sectional observational study to estimate herd level risk factors for Leptospira spp. serovars in small holder dairy cattle farms in southernChile. BMC Veterinary Research 10: 126.
Salinas MJA, Mora GJJ, Zárate RJJ, Riojas VVM, Hernández VG, Dávalos AG, Ramírez RR, Galán ALC, Ávalos RR (2005) Frecuencia de anticuerpos contra Neospora caninum en ganado bovino del norestede México. Veterinaria México 36: 303-311.
Selim AM, Elhaig MM, Gaede W (2014) Development of multiplex real-time PCR assay for the detection of Brucella spp., Leptospira spp. and Campylobacter foetus. Veterinaria Italiana 50: 269-275.
SENASICA. Servicio Nacional de Sanidad Inocuidad y Calidad Agroalimentaria, SAGARPA (2013) Frecuencia en hatos de Brucelosis en los Estados de la República Mexicana. Periodo Julio-Diciembre, 2013. www.senasica.gob.mx. Fecha de consulta 23 de septiembre de 2014.
Thrusfield M (2007) Veterinary Epidemiology, Third Edition. London: Blackwell Science. Blackwell Publishin Company. 610p.
Yang N, Cui X, Qian W, Yu S, Liu Q. (2012) Survey of nine abortifacient infectious agents in aborted bovine fetuses from dairy farms in Beijing, China, by PCR. Acta Veterinaria Hungarica 60: 83-92.